
(12分)钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。
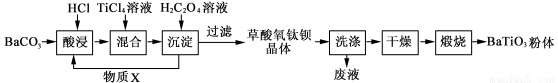
(1)酸浸时发生的反应的离子方程式为 ;为提高BaCO3的酸浸率,可采取的措施为 (任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是 。
(3)加入H2C2O4溶液时,发生反应的化学方程式为 ;
可循环使用的物质X是 。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、 和 。
(1)BaCO3+2H+ = Ba2+ + CO2↑+H2O; 将BaCO3粉碎 (2)抑制TiCl4的水解
(3)BaCl2 + TiCl4 + 2H2C2O4 + 5H2O = BaTiO(C2O4)2·4H2O↓+ 6HCl; 盐酸(或HCl)(各2分)
(4)CO2、H2O(g) (各1分)
【解析】
试题分析:(1)BaCO3不能溶于水,但是可以溶于酸,与酸发生反应产生CO2,反应的方程式是:BaCO3+2H+ = Ba2+ + CO2↑+H2O;BaCO3是固体物质,为提高BaCO3的酸浸率,可采取的措施为将BaCO3粉碎或适当提高盐酸的浓度、升高反应温度等;(2)TiCl4是强酸弱碱盐,在溶液中Ti4+容易发生水解反应使溶液显酸性,产生Ti(OH)4会使溶液变浑浊,为了抑制盐的水解,配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,然后再加水稀释;(3)向含有BaCl2、HCl、TiCl4的溶液加入H2C2O4溶液时,发生反应的化学方程式为BaCl2 + TiCl4 + 2H2C2O4 + 5H2O = BaTiO(C2O4)2·4H2O↓+ 6HCl;根据反应的物质及反应产生的物质可知,可循环使用的物质X是盐酸;(4)草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O]煅烧,可得到BaTiO3、CO2、H2O(g)。
考点:考查化学反应的离子方程式、化学方程式的书写、影响化学反应速率的因素、反应条件的控制、物质反应产物的成分的确定的知识。


科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:选择题
6.对达到平衡状态的可逆反应:X+Y  W+Z,在t℃时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是:
W+Z,在t℃时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是:

A.X、Y、W为气体,Z不是气体
B.X、Y为气体,W、Z中有一种是气体
C.W、Z为气体,X、Y中有一种是气体
D.W、Z中有一种为气体,X、Y都不是气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都郫县高三第二次阶诊断性考试理综化学试卷(解析版) 题型:实验题
(14分)某学习小组用下图装置测定镁铝合金中铝的质量分数和铝的相对原子质量。
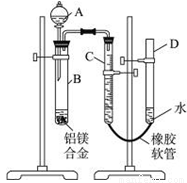
(1)A中试剂为______________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是____。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;
③待B中不再有气体产生并恢复至室温后,记录C的液面位置;
④由A向B中滴加足量试剂。
上述操作的顺序是___________(填序号);在进行操作③时记录C的液面位置时,除视线平视外,还应_ 。
(4)B中发生反应的化学方程式为___________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为_______________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期期末理综化学试卷(解析版) 题型:选择题
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是
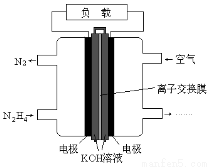
A.电流从右侧电极经过负载后流向左侧电极
B.负极发生的电极反应式为N2H4+4OH--4e-=N2+4H2O
C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极 表面的吸附量,并使它们与电解质溶液充分接触
D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:填空题
(12分)氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物。
(1)肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),若反应中有4mol N-H 键断裂,则形成的π键有 mol。
(2)F2和过量NH3在铜催化作用下反应生成NF3,NF3分子的空间构型为 。
(3)铁和氨气在640℃发生置换反应,产物之一的晶胞见图1。该反应的化学方程式: 。
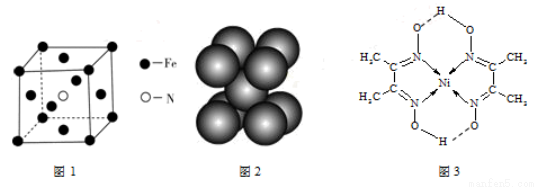
(4)叠氮化钠(NaN3)分解反应为:2NaN3(s)=2Na(l)+3N2(g),下列有关说法正确的是 。
a.常温下N2很稳定,是因为N的电负性大
b.钠晶胞见图2,每个晶胞含有2个钠原子
c.第一电离能(I1):N>O>S
d.NaN3与KN3结构类似,晶格能:NaN3<KN3
(5)配合物Y的结构见图3,Y中含有 (填序号);
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
Y中碳原子的杂化方式有 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生
B.反应NH4Cl(s)=NH3(g)+HCl(g)在室温下不能自发进行,则该反应的ΔH>0
C.由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3 沉淀
D.25℃时,0.1 mol·L-1CH3COOH溶液加水稀释后,c(OH-)/c(CH3COOH)增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:选择题
下列有关物质性质的应用错误的是
A.二氧化硅不与强酸反应,可用石英玻璃容器盛放氢氟酸
B.碳酸氢钠具有弱酸性,可用于食品发酵
C.次氯酸钠具有强氧化性,可用于配制消毒液
D.明矾能水解生成Al(OH)3胶体,可用作净水剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:选择题
在电冶铝的电解槽中存在电解质W2[X2Y2Z4],己知四种元素的简单离子的电子层结构均相同,Y原子最外层电子数为次外层的3倍,X原子最外层电子数为Y原子最外层电子数的一半,下列说法正确的是
A.原子序数:W>X>Y>Z
B.原子半径:r(w)>r(X)>r(Y)>r(Z)
C.W的最高价氧化物的水化物碱性比X的弱
D.Y的简单氢化物的稳定性比Z的强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏常州市高三第一次调研试卷化学试卷(解析版) 题型:选择题
已知:25℃时,CaCO3的Ksp为2.9×10-9,CaF2的Ksp为2.7×10-11下列说法正确的是
A.25℃时,饱和CaCO3溶液与饱和CaF2溶液相比,后者Ca2+浓度大
B.25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,会析出CaCO3固体
C.25℃时,CaCO3固体在20mL0.01mol·L-1盐酸中的Ksp比在20mL0.01mol·L-1氨水中的Ksp大
D.25℃时,在CaCO3悬浊液中加入NaF固体,CaCO3不可能全转化为CaF2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com