
| A. | X>2 | B. | X=2 | C. | 2>X>1 | D. | X=1 |
分析 0.1mol•L-1邻苯二甲酸(二元酸)溶液的pH大于1,则邻苯二甲酸为二元弱酸;当碱与酸的浓度比值(X)为2时,反应生成强碱弱酸盐邻苯二甲酸钠,溶液显示碱性;当碱与酸的浓度比值(X)为1时,邻苯二甲酸中羧基剩余,溶液显示酸性,若满足反应后溶液为中性,则1<X<2.
解答 解:已知0.1mol•L-1邻苯二甲酸(二元酸)溶液的pH大于1,说明邻苯二甲酸为二元弱酸,
当碱与酸的浓度比值X=2时,反应生成强碱弱酸盐邻苯二甲酸钠,由于邻苯二甲酸钠部分水解,溶液显示碱性;
当碱与酸的浓度比值X=1时,邻苯二甲酸中羧基剩余一半,电离程度大于水解程度,溶液显示酸性,
若等体积的两溶液混合,使反应后溶液为中性,则一定满足:1<X<2,
故选C.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,根据题中信息明确邻苯二甲酸为二元弱酸为解答关键,注意明确溶液酸碱性与溶液pH的关系及计算方法.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
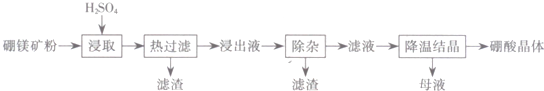
| 温度℃) | 20 | 40 | 60 | 100 |
| 溶解度(g) | 5.0 | 8.7 | 14.8 | 40.2 |
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 9.7 | 12.4 |
| 化学式 | H2CO3 | CH3COOH |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
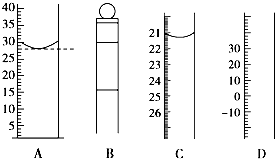 (1)图为常见仪器的部分结构(有的仪器被放大)
(1)图为常见仪器的部分结构(有的仪器被放大)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/mL | 测得生成沉淀的质量/g |
| 1 | 0.858 | 500 | 1.379 |
| 2 | 1.716 | 500 | |
| 3 | 2.574 | 500 | 4.137 |
| 4 | 3.432 | 500 | 5.516 |
| 5 | 4.290 | 500 | 5.516 |
| 6 | 5.148 | 500 | 5.516 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | V(0.5mol•L-1 HCl)/mL | m(CaCO3)/g | CaCO3状态 | V(蒸馏水)/mL | 实验目的 | |
| 实验1 | 40.0 | 0.8 | ①实验1和2探究固体表面积对反应速率的影响; ②实验1和3探究反应物浓度对反应速率的影响 | |||
| 实验2 | 40.0 | 0.8 | ||||
| 实验3 | 60.0 | 0.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com