
下列物质的转化在给定条件下不能实现的是
A.Ca(ClO)2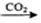 (aq)HClO(aq)
(aq)HClO(aq) HCl(aq)
HCl(aq)
B.H2SiO3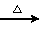 SiO2
SiO2 SiCl4
SiCl4
C.Al2O3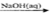 NaAlO2
NaAlO2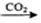 Al(OH)3
Al(OH)3
D.Fe2O3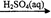 Fe2(SO4)3(aq)
Fe2(SO4)3(aq) 无水Fe2(SO4)3
无水Fe2(SO4)3
科目:高中化学 来源:2015-2016学年江西省高一下学期期中考试化学试卷(解析版) 题型:选择题
某可逆反应正向反应过程中能量变化如图所示,下列说法不正确的是 ( )
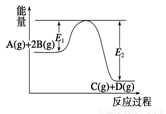
A.压强增大,平衡向正反应方向移动
B.当反应达到平衡时,降低温度,A的转化率增大
C.升高温度,平衡常数K减小;
D.加入催化剂,反应速率增大,E1减小,E2减小,反应热减小
查看答案和解析>>
科目:高中化学 来源:2016届云南省高三下第七次月考理综化学试卷(解析版) 题型:选择题
下列说法错误的是
A.硅胶疏松多孔,可用作催化剂的载体
B.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
C.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
D.氮的固定只有在高温、高压、催化剂的条件下才能实现
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:简答题
镀镍废水中含有氰根(CN-),其质量浓度往往高于国家排放标准规定的范围,需要进行破氰处理。用化学法处理电镀废水中的氰化物,一般采用碱性氰化法和双氧水氧化法。
I、碱性氯化法是在废水中加入NaOH使Ni2+生成Ni(OH)2沉淀,同时加NaClO将CN-氧化为无毒物质,但此法中ClO-在碱性条件下会和Ni2+反应生Ni(OH)3沉淀和Cl-而大量消耗,反应的离子反应方程式为_______________________________________;
Ⅱ、双氧水氧化法的简易工艺流程如下:
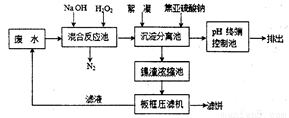
(1)混合反应池中,在碱性条件下H2O2氧化CN-却不会和Ni2+反应,此反应的离子方程式为______________;H2O2还会以质量比为25:2的比例氧化废水中的有机添加剂,降低废水的COD值。
(2)沉淀分离池中,加入焦亚硫酸钠(Na2S2O5)还原除去过量的H2O2,否则会影响沉淀的絮凝沉降,请分析原因________________________________;
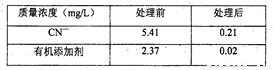
(3)向废水中加入30%H2O2(密度为1.11g/mL)的用量为1mL/L,处理前后CN-和有机添加剂的质量浓度如下表所示,若不考虑H2O2的自身分解和溶液体积的变化。请计算需在沉淀分离池中至少加入焦亚硫 酸钠(Na2S2O5)的量为_________g/L(计算结果保留到小数点后两位)。写出计算过程。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.用惰性电极电解1L1mol•L-1的CuSO4溶液,当阴极析出3.2g铜时,加入0.05molCu(OH)2固体可将溶液恢复至原浓度
B.Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H>0
C.已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl的溶解度大于Ag2CrO4的溶解度
D.25℃时,向0.1 mol•L-1 CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:选择题
下列做法与可持续发展宗旨相违背的是
A.加大清洁能源的开发利用,提高资源的利用率
B.用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用
C.加大铅酸蓄电池、含汞锌锰干电池的生产,满足消费需求
D.对工业废水、生活污水净化处理,减少污染物的排放
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:计算题
现有一套电化学装置,如下图所示,E 为沾有 Na2SO4溶液的滤纸,并加入几滴酚酞。A、B分别为Pt片,压在滤纸两端,R、S为电源的电极。M、N是用多微孔的 Ni 制成的电极材料,它在碱性溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的 KMnO4溶液,断开K,接通外电源一段时间后,C、D中有气体产生。
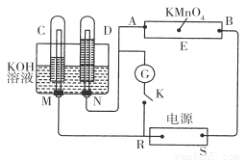
(1)S为________(填“正”或“负”)极。
(2)A极附近溶液的现象是______________, B 极附近发生的电极反应式为___________。
(3)滤纸上的紫色点向______(填“A”或“B”)方移动。
(4)当 C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,D中的电极为________ (填“正”或“负”)极,电极反应式为___________________________。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下冲刺模拟理综化学C卷(解析版) 题型:推断题
毗氟氯禾灵的合成路线如下:
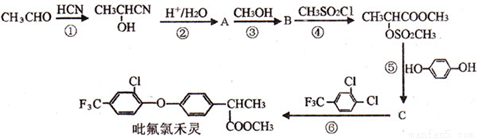
已知: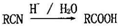
(1)B的结构简式为_____________。A的系统名称为_____________。
(2)在合成吡氟氯禾灵所涉及的反应中,属于加成反应的有___________(填序号)。
(3)写出反应⑥的化学方程式___________________。
(4)C的同分异构体有多种,写出同时具有下列性质的同分异构体的结构简式___________________。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应 c.核磁共振氢谱图中有四组峰
(5)写出由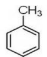 制备高分子化合物
制备高分子化合物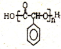 的合成路线流程图(无机试剂任选),合成流程示意图如下:
的合成路线流程图(无机试剂任选),合成流程示意图如下: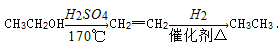
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳二中高一6月月考化学试卷(解析版) 题型:选择题
下列各组变化中,ΔH或Q前者小于后者的一组是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1; CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)=2H2O(l) ΔH1 H2(g)+1/2O2(g)===H2O(l) ΔH2
③t℃时,在一定条件下,将1molSO2和1molO2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1和Q2
④CaCO3 (s)=CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
A.①②③ B.②④ C.②③④ D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com