
下列物质中,含离子键的物质是( ),由极性键形成的极性分子是( ),由极性键形成的非极性分子是( ),由非极性键形成的非极性分子是( )。
A.CO2 B.Br2
C.CaCl2 D.H2O
★ ★★
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.常温下,反应C(s)+CO2(g)2CO(g)不能自发进行,则该反应的ΔH>0
D.反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3与BF3可以通过配位键形成NH3·BF3。
(1)配位键的形成条件是__________________________________________________
__________________________________________。
(2)NH3·BF3中____________原子提供孤对电子,
____________原子提供空轨道。
查看答案和解析>>
科目:高中化学 来源: 题型:
三氯化氮(NCl3)在常温下是一种淡黄色液体,其分子结构呈三角锥形。则下列说法正确的是( )
A.分子中N—Cl键是非极性键
B.分子中不存在孤对电子
C.它的沸点比PCl3的低
D.因N—Cl键能大,所以NCl3沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
答案 COS为直线形结构;CO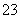 为平面正三角形结构;PCl3为三角锥形结构。
为平面正三角形结构;PCl3为三角锥形结构。
解析 COS与CO2互为等电子体,其结构与CO2相似,所以其为直线形结构;CO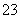 与SO3互为等电子体,结构相似,所以CO
与SO3互为等电子体,结构相似,所以CO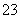 为平面正三角形结构;PCl3与NF3互为等电子体,结构相似,所以PCl3为三角锥形结构。
为平面正三角形结构;PCl3与NF3互为等电子体,结构相似,所以PCl3为三角锥形结构。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质的变化规律,与共价键键能大小有关的是( )
A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.H2O熔沸点高于H2S,HF熔沸点高于HCl
D.NaF、NaCl、NaBr、NaI的熔点依次降低
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
右图的装置中,干燥烧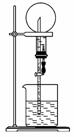 瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是( )
瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是( )
A.CO2(NaHCO3溶液)/无色喷泉
B.NH3(H2O中含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉
D.HCl(AgNO3溶液)/白色喷泉
★ ★★
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com