
【题目】由短周期元素组成的A、B、C、D、E、X均为中学化学常见物质。已知A为淡黄色固体,D为白色难溶于水的物质,且A和D的摩尔质量相等,在一定条件下它们有如下转化关系:
![]()
(1)写出A的电子式________。
(2)用离子方程式表示X的水溶液呈酸性的原因________ 。
(3)写出上述转化中C→D对应反应的离子方程式________。
【答案】![]() Al3++3H2O
Al3++3H2O ![]() Al(OH)3+3H+ 3AlO2-+Al3++6H2O=4Al(OH)3↓ ↓(或3Al(OH)4-+Al3+=4Al(OH)3↓)
Al(OH)3+3H+ 3AlO2-+Al3++6H2O=4Al(OH)3↓ ↓(或3Al(OH)4-+Al3+=4Al(OH)3↓)
【解析】
A为淡黄色固体,能与水反应,则A为过氧化钠,物质A和D的式量相等,结合转化关系,B为氢氧化钠,C为偏铝酸钠,F为铝盐,D为氢氧化铝,E为氧气。
(1)由分析可知,A为Na2O2 ,因此其电子式为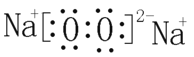 ;
;
(2)由分析可知,X为AlCl3或Al2(SO4)3 ,溶液中存在Al3+的水解,Al3++3H2O![]() Al(OH)3+3H+,使得溶液中c(H+)>c(OH-),溶液显酸性;
Al(OH)3+3H+,使得溶液中c(H+)>c(OH-),溶液显酸性;
(3)由分析可知,C为NaAlO2、D为Al(OH)3 ,该反应的离子方程式为:3AlO2-+Al3++6H2O=4Al(OH)3↓。


科目:高中化学 来源: 题型:
【题目】全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法不正确的是( )
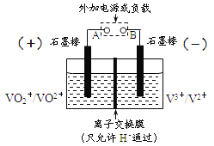
A. 充电时,每转移1mol电子,电解液中n(H+)的变化量为2mol
B. 充电时,阴极电解液pH升高
C. 放电时,右槽发生氧化反应
D. 放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现铂的两种化合物a和b
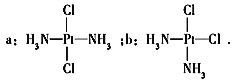
实验测得a和b具有不同的特性,a具有抗癌作用,而b没有。则下列关于a、b的叙述正确的是
A. a和b属于同一种物质
B. a和b属于手性异构体
C. a和b的空间构型是四面体
D. a和b的空间构型是平面四边形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是
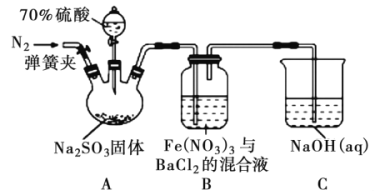
A. 装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO42-
B. 实验室中配制70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C. 三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D. 装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应2CaO2(s) ![]() 2CaO(s) + O2(g) 在一密闭的容器中达到平衡。保持温度不变,缩小容器的容积为原来的一半,重新平衡后,下列叙述正确的是
2CaO(s) + O2(g) 在一密闭的容器中达到平衡。保持温度不变,缩小容器的容积为原来的一半,重新平衡后,下列叙述正确的是
A. CaO2的量不变B. 平衡常数减小C. 氧气浓度变小D. CaO的量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是
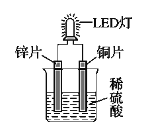
A. 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B. 如果将锌片换成铁片,电路中的电流方向将改变
C. 铜片上的电极方程式为:2H+ + 2e- = H2↑
D. 如果将稀硫酸换成柠檬汁,LED灯将不会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是
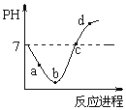
A. a点时,已经滴入NaOH溶液
B. b点所示的溶液中,只存在两种分子
C. a、b、c、d四个点中,c点水的电离程度最大
D. d点所示的溶液中,钠元素与氯元素的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T12
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1)请写出元素d的基态原子电子排布式______________________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是_________________。(填“极性键”、“非极性键”)其中b原子的杂化方式是________。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为Mr,则一个晶胞中a原子的数目为________,该晶体的密度为 _______________________________(用字母表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com