
| A、在pH=0的溶液中:Cl-、Na+、K+、C6H5-O-(C6H5一为苯基) |
| B、加入铝屑有氢气放出的溶液中:NH4+、K+、HCO3-、Br- |
| C、在H2SO3溶液中:HSO3-、K+、Cl-、Ba2+ |
| D、在葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+ |


科目:高中化学 来源: 题型:
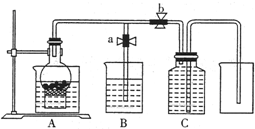 某同学设计如图所示装置来试验用粗铁粒与某浓度稀硝酸反应制取NO气体.
某同学设计如图所示装置来试验用粗铁粒与某浓度稀硝酸反应制取NO气体.
|
最终溶液中的阳离子及其物质的量 | ||||
<
|
|||||
=
|
a mol Fe3+ | ||||
大于
|
|||||
=
|
a mol Fe2+ | ||||
>
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验仪器(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、酒精灯 | 溶液的浓缩结晶 |
| B | 蒸馏烧瓶、冷凝管、酒精灯 | 由工业酒精制无水酒精 |
| C | 天平、玻璃棒、胶头滴管、容量瓶 | 配制0.5mol?L-1的溶液100mL |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 仪器 | 试剂 | 相应实验目的 |
| A | 托盘天平(带砝码)、滴管、量筒、烧杯、药匙、玻璃棒 | 食盐,蒸馏水 | 配制一定物质的量浓度的NaCl溶液 |
| B | 烧杯、漏斗、滴管、铁架台(带铁圈)、玻璃棒、滤纸、导气管 | AlCl3溶液(含少量MgCl2),烧碱,CO2,稀盐酸 | 除去AlCl3溶液中少量的MgCl2 |
| C | 酸式滴定管、滴管、铁架台(带铁夹) | 已知浓度的盐酸,未知浓度的NaOH溶液 | 测定NaOH溶液的浓度 |
| D | 分液漏斗、烧瓶、锥形瓶、导管、橡皮塞 | 稀盐酸,大理石,硅酸钠溶液 | 证明非金属性:Cl>C>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
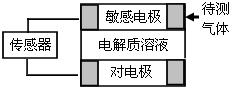 气体的自动化检测中常常应用原电池原理.如图为该电池工作的示意图:气体扩散进入敏感电极,发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.(对电极:即与敏感电极对应相反的电极)则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理.如图为该电池工作的示意图:气体扩散进入敏感电极,发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.(对电极:即与敏感电极对应相反的电极)则下列说法中正确的是( )| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
| A、检测Cl2时,电解质溶液中的阴离子向敏感电极移动 |
| B、上表气体检测时,敏感电极均作电池正极 |
| C、检测含相同物质的量的H2S和CO两份空气样本时,传感器上流过的电子物质的量之比为4:1 |
| D、检测H2S气体时,在对电极上充入空气,对电极上的电极反应式为:O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
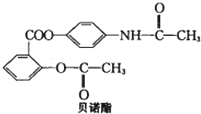
| A、分子式为C17H14O5N |
| B、在氢氧化钠水溶液中水解可以得到3种有机物钠盐 |
| C、1mol贝诺酯与H2发生加成反应最多消耗8mol H2 |
| D、贝诺酯既属于酯类又属于蛋白质类 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水中通入过量SO2:SO2+NH3?H2O═NH4++HSO3- | ||||
| B、(CH3COO)2Ba溶液中加入稀硫酸:Ba2++SO42-═BaSO4↓ | ||||
C、用铜作电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| D、Al2(SO4)3溶液中加入足量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2═2I2+2H2O | ||||
| B、向K2Cr2O7溶液中滴加少量浓硫酸,溶液变为黄色:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ | ||||
| C、0.01mol?L-1 NH4Al(SO4)2溶液与0.02mol?L-1 Ba(OH)2溶液等体积混合有白色沉淀生成:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | ||||
D、用铜电极电解饱和食盐水:2Cl-+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 装 置 | 现 象 |
 |
ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 ⅲ.试管变热,溶液沸腾 |
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
| 装 置 | 现 象 |
 |
ⅰ.实验初始,未见明显现象 ⅱ.过一会儿,出现气泡,有刺激性气味 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com