
下列各说法正确的是
A.弱电解质的导电能力一定比强电解质的导电能力弱
B.pH=4的醋酸与pH=10的NaOH溶液等体积混合后溶液显碱性
C.豆浆中加入硫酸钙会使蛋白质聚沉.
D.同浓度①NaHCO3、②Na2CO3、③CH3COONa四种溶液,pH大小顺序是②>③>①
C
【解析】
试题分析:A、电解质溶液的导电性取决于溶液中自由移动离子的浓度和离子所带的电荷,与电解质的强弱无关,错误;B、醋酸为弱电解质,pH=4的醋酸的物质的量浓度远大于10—4mol/L,氢氧化钠为强电解质,pH=10的NaOH溶液的物质的量浓度等于10—4mol/L,二者等体积混合,醋酸远过量,溶液显酸性,错误;C、豆浆为胶体,其中加入电解质硫酸钙会使蛋白质聚沉,正确;D、酸性:醋酸>碳酸>碳酸氢根,盐中的酸根对应的酸越弱,该盐的水解程度越大,同浓度①NaHCO3、②Na2CO3、③CH3COONa四种溶液,pH大小顺序是②>①>③,错误。
考点:考查电解质溶液、胶体的性质。


科目:高中化学 来源:2015届福建省高三上学期第二次质量检查化学试卷(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。

下列判断正确的是
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后, c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应⊿H>0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源:2015届福建省福州市高三上学期第三次质检理综化学试卷(解析版) 题型:选择题
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是

A.a为电池的正极
B.电池充电反应为LiMn2O4 Li1-xMn2O4+xLi
Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
下列各组试剂中,只用试管和胶头滴管,不用其他试剂就可以鉴别的是( )
A.NaHSO4溶液和Na2CO3溶液 B.稀盐酸和AgNO3溶液
C.AlCl3溶液和NH3·H2O溶液 D.Ba(OH)2溶液和NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
向FeCl3和BaCl2的酸性混合溶液中,通入SO2气体,有白色沉淀生成。此沉淀是( )
A.BaSO4 B.FeS C.BaSO3 D.S
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪一中高三上学期期中联考化学试卷(解析版) 题型:实验题
(14分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:

(1)步骤①中用硫酸酸化的目的是____________________________________________。
步骤②发生反应的离子方程式为_____________________________________________。
(2)步骤④利用了SO2的还原性,反应的离子方程式为___________________________。
(3)操作⑥的名称是________________。
(4)从含溴海水中吹出的溴也可用纯碱吸收。纯碱吸收溴的主要反应是:Na2CO3+Br2→NaBrO3+NaBr+CO2,吸收1molBr2时,转移的电子数为________mol。纯碱吸收后再用硫酸酸化,单质溴又从溶液中析出。
(5)化学上将SCN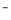 、OCN
、OCN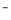 、CN
、CN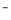 等离子称为“类卤离子”。现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成血红色;通入SO2后,血红色消失。血红色消失过程中发生反应的离子方程式为______________________________________。
等离子称为“类卤离子”。现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成血红色;通入SO2后,血红色消失。血红色消失过程中发生反应的离子方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪一中高三上学期期中联考化学试卷(解析版) 题型:选择题
将铝、铁物质的量均为0.2mol的某种铝铁合金粉末分别于下列溶液充分反应(溶液均过量),放出氢气最多的是
A.18.4mol·L-1H2SO4溶液
B.1.5mol·L-1 HCl溶液
C.4mol·L-1 HNO3溶液
D.3mol·L-1 NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪一中高三上学期期中联考化学试卷(解析版) 题型:选择题
用36.5%的浓盐酸(密度1.2 g·cm-3)配1 mol·L-1的稀盐酸 100 mL,配制过程需用到哪些仪器
①100 mL量筒 ②10 mL量筒 ③50 mL 烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒
A.①③⑤⑥⑦ B.④③⑦⑤⑥
C.③⑤⑦⑥① D.②③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中质量检测化学试卷(解析版) 题型:选择题
可逆反应 H2 (g)+ I2 (g) 2HI(g),温度一定,在1L的密闭容器中加入2molH2(g)和1molI2(g)开始反应,2min末测知容器中生成了1.2mol HI(g),下列说法正确的是
2HI(g),温度一定,在1L的密闭容器中加入2molH2(g)和1molI2(g)开始反应,2min末测知容器中生成了1.2mol HI(g),下列说法正确的是
A.H2(g)的消耗速率与I2(g)的生成速率始终相等
B.反应过程中,H2(g)和I2(g)的转化率始终相等
C.平衡前,正、逆反应速率的比值恒定
D.反应开始至2min末,v(H2)=0.3mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com