
| A. | ①②③④ | B. | ②③④ | C. | ②③④⑥ | D. | ①②④ |
分析 先确定二氧化碳和这些溶液中的溶质是否反应,若反应,再根据反应后的生成物的溶解性确定选项,以此解答该题.
解答 解:①盐酸是强酸,碳酸是弱酸,所以碳酸不能制取盐酸,即二氧化碳和氯化钙不反应,最终没有沉淀析出,故①错误;
②碳酸是弱酸,硅酸是更弱的酸,所以二氧化碳和硅酸钠能反应生成硅酸,硅酸是不溶于水的物质,所以最终有沉淀析出,故②正确;
③NaAlO2溶液中通入过滤二氧化碳会生成氢氧化铝沉淀,所以最终有沉淀析出,故③正确;
④碳酸钠能和水、二氧化碳反应生成碳酸氢钠,碳酸氢钠的溶解性小于碳酸钠的溶解性,所以该溶液中会有碳酸氢钠析出,故④正确;
⑤Ca(OH)2溶液中通入过滤二氧化碳气体先生成碳酸钙沉淀,继续通入二氧化碳气体测定会溶解,最后无沉淀生成,故⑤错误;
⑥次氯酸是比碳酸还弱的酸,所以二氧化碳、水和次氯酸钙反应生成碳酸钙沉淀,但二氧化碳是过量的,过量的二氧化碳和碳酸钙能继续反应生成可溶性的碳酸氢钙,所以最终没有沉淀析出,故⑥错误;
故选B.
点评 本题考查综合考查元素化合物知识,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意次氯酸是比碳酸还弱的酸,但次氯酸是强氧化性酸.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到导管中甲处液面下降,乙处液面上升.关于该反应的叙述正确的是( )
某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到导管中甲处液面下降,乙处液面上升.关于该反应的叙述正确的是( ) | A. | ①②③ | B. | ①③ | C. | ①② | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
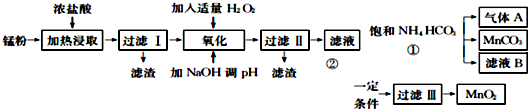
| 氢氧化物 | Fe(OH) | Fe(OH) | Mn0H)2 | Zn(OH)2 |
| 开始沉淀的pH | 7.5 | 2.2 | 8.8 | 6.4 |
| 沉淀完全的pH | 9.5 | 3.7 | 10.8 | 8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
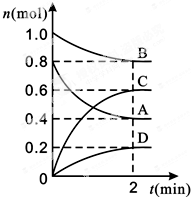 T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:
T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com