
【题目】用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1molCu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为( )
A.0.4mol
B.0.5mol
C.0.6mol
D.0.8mol
【答案】C
【解析】电解硫酸铜时,初阶段:2CuSO4+2H2O ![]() 2Cu↓+O2↑+2H2SO4 , 后阶段:2H2O
2Cu↓+O2↑+2H2SO4 , 后阶段:2H2O ![]() 2H2↑+O2↑,如果只按照第一阶段的电解,反应只需要加入CuO或CuCO3就可以,但是现在加入的是Cu2(OH)2CO3 , 相当于多加入了0.2molCuO和0.1molH2O,这0.1mol的水,应该是第二阶段的反应进行,该阶段转移了0.2mol电子,第一阶段转移了0.4mol电子,所以总共转移电子0.6mol。
2H2↑+O2↑,如果只按照第一阶段的电解,反应只需要加入CuO或CuCO3就可以,但是现在加入的是Cu2(OH)2CO3 , 相当于多加入了0.2molCuO和0.1molH2O,这0.1mol的水,应该是第二阶段的反应进行,该阶段转移了0.2mol电子,第一阶段转移了0.4mol电子,所以总共转移电子0.6mol。
故答案为:C电解硫酸铜溶液过程中,当溶液中的铜离子完全反应后,溶液中的水参与反应。由加入“0.1molCu2(OH)2CO3”确定有0.1mol水参与电解,据此结合电极反应式计算转移电子数。


科目:高中化学 来源: 题型:
【题目】我国预计在2020年前后建成自己的载人空间站,为循环利用人体呼出的CO2并提供氧气。我国科学家设计了一种装置(如图所示),实现“太阳能→电能→化学能”转化,总反应为2CO2=2CO+O2,下列有关说法不正确的是
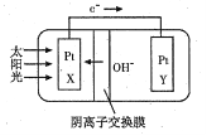
A. 该装置属于电解池
B. X极发生氧化反应,Y极发生还原反应
C. 人体呼出的水蒸气参与Y极反应:CO2+H2O+2e-=CO+2OH-
D. X极每产生标准状况下22.4L气体,有2mol的OH-从Y极移向X极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置做铝热反应实验。下列说法不正确的是( )

A.该反应的方程式是2Al+Fe2O3 ![]() 2Fe+Al2O3
2Fe+Al2O3
B.该反应产生高温,发出强光
C.根据铝热反应原理,可以冶炼某些金属
D.若反应中转移3 mol电子,则消耗氧化剂的物质的量是1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 ___________ .
(2)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达![]() ,有关反应的离子方程式为_________________;
,有关反应的离子方程式为_________________;
(3)从理论上考虑,下列物质也能吸收Br2的是____________.
A. H2O B. Na2CO3 C. Na2SO3 D. FeCl3
(4)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,![]() 的沸点为
的沸点为![]() ,微溶于水,有毒性和强腐蚀性。步骤Ⅲ的操作中对盛有工业溴的蒸馏烧瓶采取的加热方式是__________ ,溴蒸汽冷凝后得到液溴和溴水的混合物,可利用它们的相对密度相差较大的特点进行分离,所用的分离仪器名称是__________ .
,微溶于水,有毒性和强腐蚀性。步骤Ⅲ的操作中对盛有工业溴的蒸馏烧瓶采取的加热方式是__________ ,溴蒸汽冷凝后得到液溴和溴水的混合物,可利用它们的相对密度相差较大的特点进行分离,所用的分离仪器名称是__________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家合成了一种新型除草剂的合成路线如下:
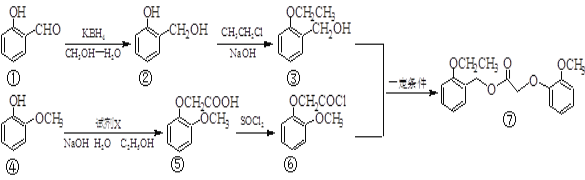
(1)① 中两种含氧官能团的名称_______、_____。除草剂⑦的分子式为_______ 。
(2)③与⑥生成⑦的反应类型是____,④⑤转化中另外一种产物是HCl,则试剂X是_____ 。
(3)写出一种同时满足下列条件的物质③的同分异构体的结构简式______________。
① 属于芳香族化合物; ② 苯环上的一取代物只有两种;
③ 在铜催化下与O2反应,其生成物1 mol与足量的银氨溶液反应生成4 mol Ag
(4)写出②③的化学方程式__________________________________________。
(5)卡巴拉丁是老年人认知障碍的重要治疗药物。请结合上述合成路线及下面所给的反应:![]()
ROH+SOCl2RCl+HOSOCl
请写出合成卡巴拉丁流程中A、B、D的结构简式,C试剂的化学式。
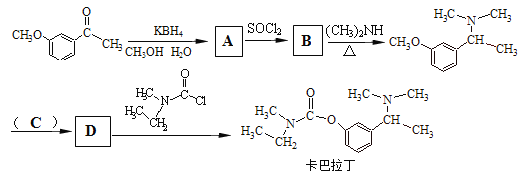
A:____________、B:_____________、C:____________、D:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究金属的腐蚀情况,某同学将锌片和铜片置于浸有饱和食盐水和酚酞的滤纸上,并构成如图所示的装置。下列判断合理的是( )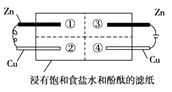
A.左边铜片上有气泡冒出
B.右边锌片上的反应为2Cl-- 2e-=Cl2↑
C.最先观察到红色的区域是②
D.两铜片质量均不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期的5种主族元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素原子电子层数之和是5;B原子的最外层电子数是其电子层数的2倍;D的一种单质是一种有特殊臭味的淡蓝色气体,可用于杀菌消毒;E与A在同一主族。
请回答下列问题:
(1)A与E可形成化合物甲,甲与水反应可生成H2,写出甲的电子式:__________________。
(2)甲与AlCl3反应得到NaAlH4,甲与NaAlH4都是重要的还原剂,写出NaAlH4与水发生反应的化学方程式:____________________________________。
(3)某同学认为;用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与E的单质反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2;即可证明得到的甲一定是纯净的。判断该同学设想的制备和验纯方法的合理性并说明理由:____________________________________。
(4)C元素的气态氢化物也具有一定的还原性,写出其与CuO反应的化学力程式:____________________________________。
(5)B、D、E组成的一种盐中,B的质量分数为17.91%,其水溶液能使酸性高锰酸钾溶液褪色,写出该盐的化学式:_______________。常温下,该盐的水溶液中离子浓度由大到小的顺序为:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲及其化合物是半导体材料。
(1)25℃时,H2TeO3(亚碲酸):Ka1=1.0×10-3、Ka2=2.0×10-8。在该温度下,0.1mol·L-1H2TeO3溶液的pH约为_____________(填代号)。
A.0.7 B.1 C.2 D.5
NaHTeO3溶液中,H2TeO3、HTeO3-、TeO32-浓度大小的排序为____________________。
(2)工业上,常用铜阳极泥(主要成分是Cu2Te,含少量的Ag、Au)冶炼碲,其工艺流程如下(已知TeO2微溶于水,易与浓强碱.浓强酸反应):
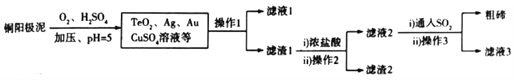
①铜阳极泥溶于硫酸时加压的目的是_____________________________________________;
若调节pH时,pH过低,则粗碲产率会_____________(填“增大”“减小”或“不变”)。
②上述流程中可以循环利用的物质是____________________。
③写出铜阳极泥转化成TeO2的化学方程式:___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com