
| 实 验 步 骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的10mL 0.5mol/L BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体. | 无现象 | 假设一成立 |
| 实验2:在盛有不含O2的10mL 0.5mol/L Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体. | 白色沉淀生成 |
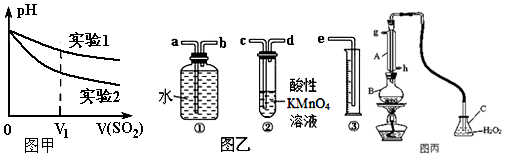
分析 Ⅰ.(1)①根据强酸制取弱酸的原理,亚硫酸是弱酸不能制备盐酸,故实验1无现象;二氧化硫溶于水后生成H2SO3,亚硫酸电离出氢离子:H2SO3?2H++SO32-,H+、NO3-结合生成具有强氧化性的HNO3,硝酸将亚硫酸根离子氧化成硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡;
②用 BaCl2溶液作对比试验观察反应现象;
(2)试验1中,二氧化硫溶于水后生成H2SO3,亚硫酸电离出氢离子,所以溶液的pH减小;试验2中反应生成强电解质硫酸,则实验2的pH更小;
Ⅱ.(1)原料气通过高锰酸钾溶液,能氧化H2SO3,生成H2SO4 ,吸收二氧化硫气体,通过装置①③排水量气测定仪器和氮气的体积;装置②是吸收二氧化硫气体,高锰酸钾溶液紫色,全部反应紫色褪去,应停止通气;
(2)二氧化硫具有还原性,可以利用高锰酸钾溶液吸收,且现象明显,氢氧化钠虽能吸收二氧化硫其他单无明显现象,溴水可以吸收二氧化硫棕红色褪去,现象明显,氨水可以吸收二氧化硫,但实验现象无明显现象;
Ⅲ.(1)根据关系式2NaOH~H2SO4~SO2及氢氧化钠的物质的量计算出二氧化硫的质量,再计算出该葡萄酒中的二氧化硫含量;
(2)根据盐酸是挥发性酸,挥发的酸消耗氢氧化钠判断对测定结果的影响;可以选用非挥发性的酸或用蒸馏水代替葡萄酒进行对比实验,减去盐酸挥发的影响.
解答 解:Ⅰ.(1)①根据强酸制取弱酸的原理,亚硫酸是弱酸不能制备盐酸,故实验1无现象;
二氧化硫溶于水后生成H2SO3,亚硫酸电离出氢离子:H2SO3?2H++SO32-,H+、NO3-结合生成具有强氧化性的HNO3,硝酸将亚硫酸根离子氧化成硫酸根离子,从而生成硫酸钡沉淀,
故答案为:无现象;白色沉淀生成;
②实验一在盛有不含O2的10mL 0.5mol/L BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体,实验二在盛有不含O2的10mL 0.5mol/L Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体,对比实验观察反应现象确定硝酸根在酸溶液中具有氧化性,
故答案为:做对比实验;
(2)试验1中,二氧化硫溶于水后生成H2SO3,亚硫酸电离出氢离子:H2SO3?2H++SO32-,所以溶液的pH减小;试验2发生反应:3SO2+2H2O+2NO3-=2NO+4H++3SO42-,反应中生成了强酸硫酸,则实验2的pH小于实验1,
故答案为:3SO2+2H2O+2NO3-=2NO+4H++3SO42-;
Ⅱ.(1)原料气通过高锰酸钾溶液,能氧化H2SO3,生成H2SO4 ,吸收二氧化硫气体,通过装置①③排水量气测定仪器和氮气的体积;装置②是吸收二氧化硫气体,高锰酸钾溶液紫色,全部反应紫色褪去,应停止通气,连接装置接口顺序为:c→d→b→a→e,装置②是吸收二氧化硫气体,高锰酸钾溶液紫色,全部反应紫色褪去,应停止通气,否则二氧化硫吸收不完全,造成误差,
故答案为:c→d→b→a→e;溶液紫(或紫红)色褪去;
(2)二氧化硫具有还原性,可以利用高锰酸钾溶液吸收,且现象明显,氢氧化钠虽能吸收二氧化硫气体但无明显现象,溴水可以吸收二氧化硫棕红色褪去,现象明显,氨水可以吸收二氧化硫,但实验现象无明显现象;
故答案为:B;
Ⅲ.(1)根据2NaOH~H2SO4~SO2可知SO2的质量为:$\frac{1}{2}$×(0.0600mol/L×0.025L)×64g/mol=0.048g,该葡萄酒中的二氧化硫含量为:$\frac{0.048g}{0.25L}$=0.192g/L,
故答案为:0.192;
(2)由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸,如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响,
故答案为:盐酸易挥发;用不挥发的强酸如硫酸代替盐酸或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响.
点评 本题考查了性质实验方案的设计,题目难度中等,明确实验目的及实验原理为解答关键,试题充分考查学生的分析、理解能力及化学实验能力,注意掌握物质性质实验方案的设计与评价原则.


科目:高中化学 来源: 题型:选择题
 浓度均为0.1mol•L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg$\frac{v}{{v}_{0}}$的变化关系如图所示.下列叙述正确的是( )
浓度均为0.1mol•L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg$\frac{v}{{v}_{0}}$的变化关系如图所示.下列叙述正确的是( )| A. | 常温下,由水电离出的c(H+)•c(OH -):a<b | |
| B. | HX、HY都是弱酸,且HX的酸性比HY的弱 | |
| C. | 相同温度下,电离常数K( HX):a>b | |
| D. | lg$\frac{v}{{v}_{0}}$=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则$\frac{c({X}^{-})}{c({Y}^{-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
| A. | 等物质的量浓度的各溶液 pH 关系为:pH(Na2S)>pH(NaCN)>pH(NaHS)>pH(CH3COONa) | |
| B. | 用 0.1mol/L 的 NaOH 溶液滴定 pH 值相等的CH3COOH和 HCN 溶液,CH3COOH消耗的NaOH溶液体积 更大 | |
| C. | NaHS 和Na2S 的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)+c(H2S) | |
| D. | 某浓度的NaCN溶液的 pH=d,则其中由水电离出的c(OH-)=10-4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| B. | 24Cr原子的电子排布式是1s22s22p63s23p63d44s2 | |
| C. | 若某基态原子的外围电子排布为4d25s2,它是第五周期IVB族元素 | |
| D. | M层全充满而N层为4s1的原子和位于第四周期第ⅠA族的原子是同一种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题:
氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验步骤 | 预期现象 |
| 步骤1:实验完成后,将硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为26.0g | |
| 步骤2:将剩余固体加入蒸馏水中 | 有白色沉淀和有刺激性气味的气体生成 |
| 步骤3:用湿润的红色石蕊试纸检验步骤2中生成的气体 | 该气体能使湿润的红色石蕊试纸变蓝 此空删去 |
| 结论:经分析可初步确定猜想丙(填“甲、乙或丙”)是正确的,据此写出Mg与NO2反应的化学方程式7Mg+2NO2$\frac{\underline{\;\;△\;\;}}{\;}$4MgO+Mg3N2. | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
已知:SO +Br2+H2O―→SO
+Br2+H2O―→SO +2Br-+2H+。某溶液中可能含有Na+、NH
+2Br-+2H+。某溶液中可能含有Na+、NH 、Fe2+、K+、Br-、SO
、Fe2+、K+、Br-、SO 、SO
、SO ,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
A.肯定不含Br- B.无法确定SO 是否存在
是否存在 
C.肯定含有SO D. 肯定含有Na+
D. 肯定含有Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com