
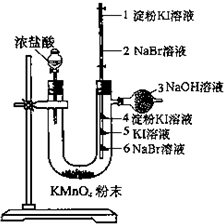
 某同学欲探究Cl2、Br2、I2之间的变化:
某同学欲探究Cl2、Br2、I2之间的变化:分析 盐酸与高锰酸钾反应生成氯气,氯、溴、碘属于同主族元素,从上到下非金属性依次减弱,单质的氧化性依次减弱,结合溴水,碘水,碘遇淀粉的颜色解答.
解答 解:盐酸与高锰酸钾反应生成氯气,
氯气氧化性强于溴单质,所以氯气与溴化钠发生反应:Cl2+2NaBr=2NaCl+Br2,溴水显黄色;
氯气氧化性强于碘单质,所以氯气与碘化钾发生反应:Cl2+2KI=2KCl+I2,碘水显棕褐色;碘遇淀粉变蓝;
溴单质的氧化性强于碘单质,所以当打开1、2处的夹子,当氯气恰好上升到2位置,保持一会儿即夹住2处,不使氯气上升.取下上节玻璃管,在2处微微加热,即看到红棕色的溴上升到1处,溴单质与碘化钾发生反应:Br2+2KI=2KBr+I2,淀粉遇碘变蓝;
故答案为:黄;棕褐; 蓝;蓝.
点评 本题通过实验考查了卤素单质的性质,题目难度不大,明确卤素单质氧化性强弱的顺序是解题关键,注意同主族元素性质的递变规律.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、SO42-、Ba2+、Cl- | B. | Na+、K+、CH3COO-、NO3- | ||
| C. | H+、Cu2+、OH-、CO32- | D. | K+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | 只有③④ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1 | B. | 0.6mol•L-1 | C. | 1.0mol•L-1 | D. | 1.6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 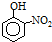 | 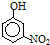 | 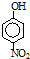 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
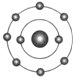 已知一般情况下原子核外最外层电子数相等的元素具有相似的化学性质.氟元素原子的核外电子排布示意图为.下列原子中,与氟元素原子的化学性质相似的是( )
已知一般情况下原子核外最外层电子数相等的元素具有相似的化学性质.氟元素原子的核外电子排布示意图为.下列原子中,与氟元素原子的化学性质相似的是( )| A. | 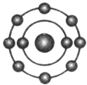 | B. | 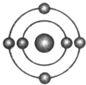 | C. | 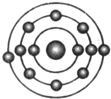 | D. | 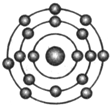 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al原子的失电子能力逐渐减弱 | |
| B. | Si、P、S元素的最高正化合价依次降低 | |
| C. | C、N、O的原子半径依次减小 | |
| D. | Cl、Br、I的气态氢化物的稳态性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com