
【题目】某学习小组为研究铁质材料与热浓硫酸的反应,设计了以下探究活动:称取铁钉(碳素钢)6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液M并收集到气体N。
(1)该小组通过认真分析,认为M溶液中既含有Fe3+,也可能含有Fe2+。若确认溶液中有无Fe2+,应加入的试剂是_____(填字母)。
a.KSCN溶液和氯水
b.铁粉和KSCN溶液
c.NaOH溶液
d.酸性KMnO4溶液
(2)将320 mL(标准状况)气体N通入足量溴水中,然后加入足量BaCl2溶液,经过________(填操作名称)、干燥后,得到固体2.33 g,气体N与溴水反应的化学方程式为______________________,计算推知气体N中SO2的体积分数为________。
(3)该小组通过对铁钉的成分和SO2体积分数的分析,认为气体N中还可能含有H2和另外一种气体Q。你认为Q应该是________,理由是_______________________________(用化学方程式表示)。
(4)取一定量N,利用下列仪器设计一个能同时检验N中含有H2和气体Q的装置(夹持仪器、橡胶管和加热装置省略),仪器的连接顺序是________________(填字母) ,其中A的作用是_______________,B中试剂X的化学式是________。
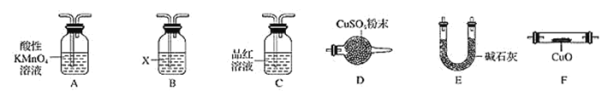
【答案】d 过滤、洗涤 SO2+Br2+2H2O=2HBr+H2SO4 71% CO2 C+2H2SO4(浓)![]() 2H2O+ CO2↑+2SO2↑ A-C-B-E-F-D 除去N中的SO2 Ca(OH)2或Ba(OH)2
2H2O+ CO2↑+2SO2↑ A-C-B-E-F-D 除去N中的SO2 Ca(OH)2或Ba(OH)2
【解析】
(1)实验室在检验Fe2+时,可利用+2价亚铁离子能使酸化的高锰酸钾褪色来检验;
(2)生成的SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,利用硫元素的守恒,结合关系式:SO2→BaSO4求出SO2的体积分数;
(3)碳单质和浓硫酸在加热的条件下生成二氧化碳和二氧化硫;
(4)根据二氧化碳和二氧化硫的性质来检验其存在,二氧化碳检验之前要先把二氧化硫除净。
(1)Fe+2Fe3+=3Fe2+,+2价亚铁离子能使酸化的高锰酸钾褪色,溶液中已经有+3价铁离子,选择a会造成干扰,选b只能检验溶液中含有+3价铁离子,选c会造成两种沉淀,受氢氧化铁颜色的影响无法辨别,只能选d,故答案为:d;
(2)SO2具有还原性,通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4,生成的硫酸遇到氯化钡会产生白色沉淀,可以先洗涤然后再过滤来获得纯净的硫酸钡沉淀,已知n(混合气体)=![]() mol,由SO2~BaSO4可知SO2的物质的量为
mol,由SO2~BaSO4可知SO2的物质的量为![]() =0.01mol,则SO2的体积分数:
=0.01mol,则SO2的体积分数: ×100%≈71%;
×100%≈71%;
(3)在反应的过程中,碳单质可以和浓硫酸反应生成二氧化碳、二氧化硫等气体,发生反应的化学方程式为C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
(4)推断所得的气体中可能含有二氧化碳,结合图中设计装置的目的,可知检验二氧化碳的方法是首先将二氧化硫除去→确认二氧化硫已经完全除去→澄清石灰水,对于氢气的检验则可通过与灼热氧化铜的反应现象和对产物水的验证来实现,验证气体存在的顺序为:SO2→CO2→CO和H2被氧化→H2O→CO2,实验中要避免其它物质的性质干扰,顺序为:A-C-B-E-F-D(或A-C-B-E-F-D-E),其中A酸性高锰酸钾溶液的作用是除去二氧化碳中的SO2,B中试剂X的作用是检验并除去二氧化碳,可以用Ca(OH)2或 Ba(OH)2。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】工业炼铁过程中涉及到的主要反应有:
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
回答下列问题:
(1)![]() ________
________![]() 。
。
(2)![]() 时,向容积为
时,向容积为![]() 的恒容密闭容器中加入
的恒容密闭容器中加入![]()
![]() 和
和![]()
![]() 发生反应③,5min时达到平衡,平衡时测得混合气体中
发生反应③,5min时达到平衡,平衡时测得混合气体中![]() 的体积分数为80%,则0~5min内反应的平均速率
的体积分数为80%,则0~5min内反应的平均速率![]() ________
________![]() ,该温度下反应的平衡常数为________,下列选项中能够说明该反应已经达到平衡状态的是________(填标号)。
,该温度下反应的平衡常数为________,下列选项中能够说明该反应已经达到平衡状态的是________(填标号)。
A.固体的物质的量不再变化
B.体系的压强保持不变
C.混合气体的平均摩尔质量保持不变
D.单位时间内消耗![]() 和生成
和生成![]() 的物质的量相等
的物质的量相等
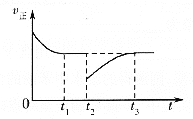
(3)一定条件下进行反应③,正向反应速率与时间的关系如图所示,![]() 时刻改变了一个外界条件,可能是________。
时刻改变了一个外界条件,可能是________。
(4)向密闭容器中加入足量的![]() 、
、![]() 和一定量的
和一定量的![]() 、
、![]() ,在
,在![]() 和
和![]() 下,反应③体系中
下,反应③体系中![]() 和
和![]() 的分压随时间变化的关系如图所示(已知温度:
的分压随时间变化的关系如图所示(已知温度:![]() )
)
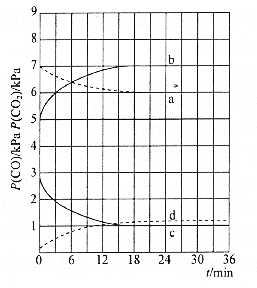
![]() 时,
时,![]() 随时间变化关系的曲线是________,
随时间变化关系的曲线是________,![]() 时,
时,![]() 随时间变化关系的曲线是________。向
随时间变化关系的曲线是________。向![]() 时已经达到平衡状态的反应③体系中再充入一定量的
时已经达到平衡状态的反应③体系中再充入一定量的![]() ,再次达到平衡时,
,再次达到平衡时,![]() 与
与![]() 的物质的量之比为________。
的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2O含有的分子数为 NA
B. 通常状况下,NA 个CO2分子占有的体积为22.4L
C. 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl—个数为2NA
D. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:

已知:①R-Br![]()
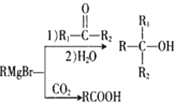
②E的核磁共振氢谱只有一组峰;
③C能发生银镜反应;
④J是一种酯,分子中除苯环外还含有一个五元环。
回答下列问题:
(1)由A生成B的化学方程式为__________,其反应类型为__________;
(2)D的化学名称是__________,由D生成E的化学方程式为__________;
(3)J的结构简式为__________;
(4)G的同分异构体中核磁共振氢谱有4组峰且能与FeCl3溶液发生显色反应的结构简式__________(写出一种即可);
(5)由甲醛和化合物A经下列步骤可得到2—苯基乙醇:A![]() K
K![]() L
L![]()
![]() 。反应条件1为__________;反应条件2所选择的试剂为__________;L的结构简式为__________。
。反应条件1为__________;反应条件2所选择的试剂为__________;L的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mn2+催化H2O2分解:2H2O2(aq)===2H2O(l)+O2(g) ΔH1,其反应机理如下:

若反应Ⅱ的晗变为ΔH2,反应Ⅰ、Ⅱ的化学计量数均为最简整数比,则反应Ⅰ的晗变ΔH为( )
A. ΔH1+ΔH2 B. ΔH1-ΔH2 C. 2ΔH1-ΔH2 D. ΔH1-2ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0℃、101 kPa条件下的H2体积为44.8 mL),下列说法不正确的是
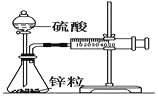
A. 用锌粒表示10 s内该反应的速率为0.013 g·s-1
B. 忽略锥形瓶溶液体积的变化,用H+来表示10 s内该反应的速率0.01 mol·(L·s)-1
C. 忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内反应的速率0.01 mol·(L·s)-1
D. 用H2表示10 s内该反应的速率为0.004 mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的百分含量与时间的关系如图2所示。则下列结论正确的是( )

A.容器中发生的反应可表示为3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol/(L·min)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应方程式对应的离子方程式正确的是
A.CuCO3+2NaOH=Cu(OH)2↓+Na2CO3 Cu2++2OH-=Cu(OH)2↓
B.Ba(OH)2+H2SO4=BaSO4↓+2H2O Ba2++SO![]() =BaSO4↓
=BaSO4↓
C.AgNO3+NaCl=AgCl↓+NaNO3 Ag++Cl-=AgCl↓
D.Cu(OH)2+H2SO4=CuSO4+2H2O OH-+H+=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用图示装置制取氯气,下列说法不正确的是( )
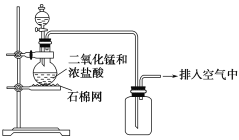
A. 该装置图中至少存在两处明显错误
B. 为了防止氯气污染空气,必须进行尾气处理
C. 在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出
D. 该实验中收集氯气的方法不正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com