
定条件下,存在 可逆反应X(g)+2Y(g)
可逆反应X(g)+2Y(g)  3Z(g),若X、Y、Z起始浓度分别为
3Z(g),若X、Y、Z起始浓度分别为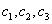 (均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.2mol/L,0.06mol/L,则下列判断不合理的是 ( )
(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.2mol/L,0.06mol/L,则下列判断不合理的是 ( )
A.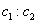 =l:2
=l:2
B.达平衡状态时,生成Z的速率是生成X速率的3倍
C.X、Y的转化率不相等
D.C2的取值范围为
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列关于SO2的说法中,不正确的是( )
A.SO2不能用来漂白食品 B.SO2具有漂白性,可以使品红溶液褪色
C.SO2与水反应生成H2SO4 D.SO2是一种大气污染物,它主要来自于化石燃料的燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
一常见碳氢化合物A,不使溴水褪色.0.5摩尔A完全燃烧时,得到1.5摩尔水和67.2二氧化碳(标准状况).
(1)通过计算,判断A是什么物质?
(2)根据下列条件,写出有关化学方程式(有机物用结构简式):
(a)在催化剂FeCl3的作用下,A与氯气反应生成B.
(b)用铜作催化剂在高温加压下,B在碱溶液里水解制得C.
(c)在催化剂作用下, C与甲醛反应,得到一种高聚物.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中能大量共存的是 ( )
①无色溶液中:K+、Na+、MnO-4、SO2-4
②pH=11的溶液中:CO2-3、Na+、AlO-2、NO-3
③加入Al能放出H2的溶液中:Cl-、HCO-3、SO2-4、NH+4
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br一
⑤有较多Fe3+的溶液中:Na+、H+、SCN-、HCO- 3
3
⑥酸性溶液中:Fe2+、Al3+、NO-3、I- 、Cl—
A.①② B.③⑥ C.②④ D.⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系:A在碱性条件T反应生成B、C,B、C在酸性条件下生成A(部分产 物及反应条件已略去)。下列判断正确的是 ( )
物及反应条件已略去)。下列判断正确的是 ( )
A.反应①和②一定为氧化还原反应
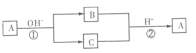 C.反应①和②互为可逆反应
C.反应①和②互为可逆反应
B.X元素不一定为非金属元素
D.X元素可能为Al
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,不正确的是
A.原子最外层电子数比次外层电子数多的元素一定位于第周期
B.从氟到碘,单质与氢气发生化合反应越来越难
C.14C和14N两种核素的质量数相同,中子数也相同
D.离子化合物中可能含有共价键,但共价化合物中一定不含离子健
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)铅蓄电池的电池总反应式为:
Pb+PbO2+4H++2SO42- 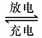 2PbSO4+2H2O回答下列
2PbSO4+2H2O回答下列
问题。(不考虑氢、氧的氧化还原)
①放电时:负极的电极反应式是 ,
电解液中H2SO4的浓度将变________,当外电路通过
2mol电子时,理论上负极板的质量增加 g。
②在完全放电耗尽PbO2和Pb时,将原Pb和PbO2极板
按右图连接,电解一段时间后,则在A电极上生成 __________,B电极上?生成________。
(2)三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
a.可用铁作阳极材料
b.电解过程中阳极附近溶液的pH升高
c.阳极反应方程式为:2Cl--2e-=Cl2↑
d.1 mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com