
【题目】(化学—有机化学基础)瘦肉精又名克伦特罗(4-氨基-α-叔丁胺甲基-3,5-二氯苯甲醇),是一种β2肾上腺素受体激动剂,临床上用于治疗哮喘。可由下图所示路线合成:

其中X表示某中间物质,请回答下列问题。
(1)判断反应④的反应类型 。
(2)书写反应③所代表的化学反应方程式:
。
(3)试推断中间物质X的结构简式: 。
(4)对氨基苯乙酮![]() 的同分异构体有多种,请写出符合以下条件的其中任意一种
的同分异构体有多种,请写出符合以下条件的其中任意一种
a.苯环与氨基相连 b.与新制的Cu(OH)2悬浊液加热,有红色物质生成
c.苯环上有2个取代基
(5)①②③代表的整个反应过程完成了苯胺对位的酰基化,也完成了对 (填官能团名称)的保护,同时也避免了一些副反应的发生。
【答案】(8分)
(1)取代反应(1分)
(2)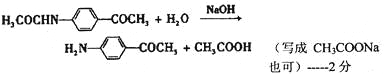
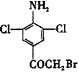
(3)
…………2分
(4)![]() ;邻,间位也可…………2分
;邻,间位也可…………2分
(5)氨基…………1分
【解析】
试题(1)对比反应④中反应物、产物的结构,可知反应物中氨基邻位苯环上氢原子被Cl取代;
(2)对比反应③中反应物、产物的结构,可知发生肽键的水解反应,生成的乙酸可以与氢氧化钠反应生成乙酸钠与水;
(3)对比X的前、后物质的结构,-COCH3中-CH3被Br原子取代生成X,X中- COCH2Br中溴原子被取代;
(4)对氨基苯乙酮 (![]() ) 的同分异构体符合以下条件:a.苯环与氨基相连,b.与新制的Cu(OH)2悬浊液加热,有红色物质生成,含有-CHO,c.苯环上有2个取代基,除去氨基外,另外的取代基为-CH2CHO;
) 的同分异构体符合以下条件:a.苯环与氨基相连,b.与新制的Cu(OH)2悬浊液加热,有红色物质生成,含有-CHO,c.苯环上有2个取代基,除去氨基外,另外的取代基为-CH2CHO;
(5)①②③代表的整个反应过程完成了苯胺对位的酰基化,对比结构可知,开始氨基反应,后又得到氨基,反应中保护氨基。
解析:(1)对比反应④中反应物、产物的结构,可知反应物中氨基邻位苯环上氢原子被Cl取代,反应④属于取代反应;
(2)对比反应③中反应物、产物的结构,可知发生肽键的水解反应,生成的乙酸可以与氢氧化钠反应生成乙酸钠与水,反应方程式为:![]() ;
;
(3)对比X的前、后物质的结构,-COCH3中-CH3被Br原子取代生成X,X中- COCH2Br中溴原子被取代,则X的结构简式为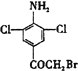 ;
;
(4)对氨基苯乙酮 (![]() ) 的同分异构体符合以下条件:a.苯环与氨基相连,b.与新制的Cu(OH)2悬浊液加热,有红色物质生成,含有-CHO,c.苯环上有2个取代基,除去氨基外,另外的取代基为-CH2CHO,其中一种为
) 的同分异构体符合以下条件:a.苯环与氨基相连,b.与新制的Cu(OH)2悬浊液加热,有红色物质生成,含有-CHO,c.苯环上有2个取代基,除去氨基外,另外的取代基为-CH2CHO,其中一种为![]() ;
;
(5)①②③代表的整个反应过程完成了苯胺对位的酰基化,对比结构可知,开始氨基反应,后又得到氨基,反应中保护氨基,避免了一些副反应的发生。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
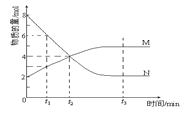
A.反应的化学方程式:2M![]() N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:

(1)滤液甲的主要成分是(写化学式___________________________________________。
(2)写出反应Ⅱ的离子方程式:______________________________________________。
(3)结合反应Ⅱ,判断下列微粒结合质子(H+)的能力,由强到弱的顺序是__________(填字母)。
A.AlO![]() B.OH- C.SiO
B.OH- C.SiO![]()
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为________________________________________________________________________。
(5)取(4)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol·L-1盐酸溶液,当加入50.0 mL盐酸溶液时,生成的沉淀恰好溶解。
加入50.0 mL盐酸溶液发生的离子反应的先后顺序依次为:____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如下表。下列有关说法不正确的是
溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
pH | 7.5 | 11.6 | 9.7 | 8.3 |
A. 同温度同浓度下,酸性由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数约为9×10-13
HF+OH-的平衡常数约为9×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:c(CO32-)+c(HCO3-)+ c(H2CO3)=0.2mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(F-)>c(Na+)> >c (H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份。
(1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]:n(NH4Cl)为___________。

(2)另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=_____(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Li和石墨的复合材料以及纳米Fe2O3材料作电极的锂离子电池,在循环充放电过程中可实现对磁性的可逆调控(如图)。下列有关说法一定错误的是

A. 该电池的电解质溶液可以是硫酸溶液
B. 放电时,总反应式是6Li+Fe2O3=3Li2O+2Fe
C. 充电时,阳极的电极反应是2Fe+3Li2O-6e-= Fe2O3+6Li+
D. 充放电过程中,电池可在被磁铁不吸引和吸引之间循环调控
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用平衡移动原理解释的是
A. 用排饱和食盐水的方法收集氯气
B. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
C. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
D. 锌与稀硫酸反应,加入少量硫酸铜反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有100mL混合气体,可能由NH3、HCl、CO2、NO组成,将此气体通过浓H2SO4,气体体积减少30mL,再通过固体Na2O2后,气体体积又减少15mL,最后通过水后,变为45mL(同温同压,水蒸气体积不计),则原混合气体中各成份的体积之比:V(NH3):V(HCl):V(CO2):V(NO)正确的是()
A.3∶0∶1∶6B.0∶6∶3∶1C.6∶0∶3∶11D.3∶2∶1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com