
Ⅰ.已知:H2A的A2-可表示S2-、S 、S
、S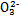 、Si
、Si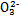 或C
或C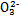 等离子。
等离子。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空: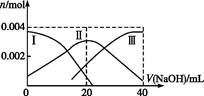
①当V(NaOH)="20" mL时,溶液中离子浓度大小关系: 。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水 (填“大”“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入 。
(2)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW= 。
Ⅱ.已知:在25 ℃时 H2O H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 ,具体数值= ,当升高温度时,Kh将 (填“增大”“减小”或“不变”)。
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1:V2=________。(溶液体积变化忽略不计)
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,据题意,回答下列问题:
①若该水溶液由0.1 mol·L-1 HA溶液与0.1 mol·L-1NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是________。
③若该溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol·L-1 |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
25 ℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
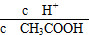 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.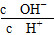
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
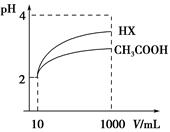
(1)已知在常温下测得浓度均为0.1 mol/L的下列5种溶液的pH: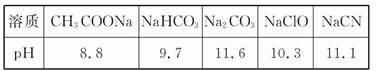
根据上述信息判断,浓度均为0.05 mol/L的下列5种物质的溶液中,pH最小的是 (填编号);其pH为 (填数值);pH最大的是 (填编号)。
①CH3COOH ②HCN ③HClO ④H2SO4 ⑤HClO4
(2)下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液。
②在侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体。
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体。
根据上述反应,总结出复分解反应发生的一个规律: ;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是 ,
请写出反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
)2013年全国各地连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害,因此研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I.脱硫技术能有效控制SO2对空气的污染。
(1)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、CI-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示: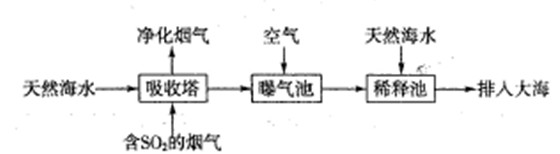
①向曝气池中通入空气的目的是
②通入空气后曝气池中海水与天然海水相比,浓度没有明显变化的离子是 。
a.Cl- B.SO42- C.HCO3-
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)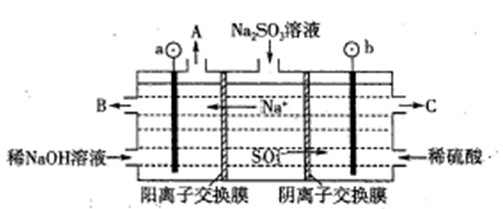
①图中b极要连接电的(填“正”或“负”) 极,C口流出的物质是 。
②SO32-放电的电极反应式为
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因 。
II.我国的能消费结构以燃煤为主,将煤气化可减少环境污染,但煤气化过程中能产生有害气体H2S,用足量的Na2CO3溶液可吸收,该反应的离子方程式为 。
(已知:H2S Kal=9.1×10-8;Ka2=1.1 ×10-12;H2CO3 Kal=4.30×10-7;Ka2=5.61 ×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
①HA+HB-(少量)=A-+H2B ②H2B(少量)+C-=HB-+HC
③HA(少量)+C-=A-+HC
若H2B的Ka1=4.3×10-7,则另二种酸对应的电离常数分别为(根据已知数据填
空):HA的Ka= ,HC的Ka= 。
(2)25 ℃时0.1 mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、
HR-、R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质
为 (填化学式)。
(3)下图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。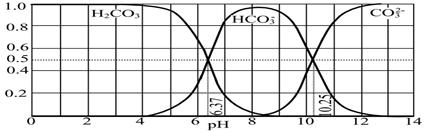
①下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
②已知Ksp(CaCO3)=5.0×10-9,在10 mL 0.02 mol·L-1的Na2CO3溶液中,加入某浓度的盐酸,调节溶液的pH=10.25,此时溶液的体积恰好为100 mL,向该溶液中加入1 mL 1×10-4 mol·L-1的CaCl2溶液,问是否有沉淀生成? (填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在常温下向20mL 0.1 mol·L-1某酸(用HAc表示)溶液中逐滴加入0.1 mol·L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化)。请根据表中数据和滴定曲线回答以下问题:
| V(NaOH)mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| pH | 3.0 | 4.7 | 5.7 | 6.7 | 7.7 | 8.7 | 9.7 | 10.7 | 11.7 | 12.5 |
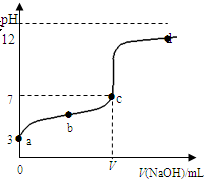
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
回答下列问题。
(1)常温时,FeCl3溶液的pH 7(填“>”、“<”或“=”),实验室配制FeCl3溶液时常将FeCl3固体先溶于较浓的盐酸溶液中,然后再用蒸馏水稀释到所需的浓度,原因是 ;将FeCl3溶液蒸干、灼烧,此过程中所涉及到的化学方程式是 。
(2)25℃时,向0.1 mol·L-1氨水中加入少量NH4Cl固体,当固体溶解后,测得溶液pH减小,主要原因是 。
(3)某溶液中只存在OH-、H+、Na+、CH3COO-四种离子。
①若溶液中只溶解了一种溶质,该溶质的名称是 ,该溶液中四种离子的浓度由大到小的顺序为 。
②若溶液中四种离子的大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则溶液中溶质的化学式为 。
③若溶液中c(Na+)=c(CH3COO-),则该溶液显 (填“酸性”、“碱性”、“中性”),该溶液由体积相等的稀NaOH和CH3COOH溶液混合而成,则混合前c(NaOH) c(CH3COOH)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为:y<x;②浓度均为0.1mol·L-1A和E溶液,pH:A<E;③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是 溶液,判断理由是 。
(2)用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是 (填写序号)。
①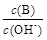 ②
②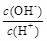 ③c(H+)和c(OH-)的乘积 ④OH-的物质的量
③c(H+)和c(OH-)的乘积 ④OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如右图中的_________曲线(填写序号) 。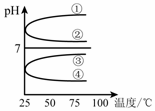
(5)室温下,向0.01mol·L-1 C溶液中滴加0.01mol·L-1 D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com