
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+。②Cr2O72-+H2O![]() 2CrO42-+2H+。③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
2CrO42-+2H+。③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe2+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.2 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1) 实验室用18.4mol/L的浓硫酸配制480mL2mol/L的硫酸,需量取浓硫酸_____mL;配制时除量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有______________。
(2) H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:__________。
(3过滤II操作得到的滤渣主要为______(填化学式),滤液II中含有的离子主要有__。
(4) 钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有_______________。
(5) 写出上述流程中用SO2进行还原时发生反应的离子方程式__________。
【答案】54.3 500mL容量瓶、胶头滴管 2Cr3++3H2O2+H2O=Cr2O72-+8H+ Fe(OH)3、 Al(OH)3 Na+、 SO42-、 CrO42- Mg2+、 Ca2+ 2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH-
【解析】
(1)实验室用18.4mol/L的浓硫酸配制480mL2mol/L的硫酸,需用500mL容量瓶,根据稀释前后硫酸物质的量不变,列式计算需量取浓硫酸的体积;定容时用容量瓶和胶头滴管;(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,Cr化合价升高,Cr3+是还原剂,则H2O2是氧化剂,根据得失电子守恒配平方程式;(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+;根据常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH,加入氢氧化钠,调节溶液PH=8,可以生成Fe(OH)3、 Al(OH)3沉淀;(4)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,结合溶液中含有的阳离子,分析利用钠离子交换树脂可除去滤液II中的金属阳离子;(5)Cr2O72-被SO2还原生成Cr(OH)(H2O)5SO4。
(1)实验室用18.4mol/L的浓硫酸配制480mL2mol/L的硫酸,需用500mL容量瓶;设需量取浓硫酸的体积为vmL,根据稀释前后硫酸物质的量不变,18.4mol/L![]() =500mL
=500mL![]() 2mol/L,v=54.3mL;配制时除量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有500mL容量瓶、胶头滴管;(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,Cr化合价升高,Cr3+是还原剂,则H2O2是氧化剂,反应离子方程式是2Cr3++3H2O2+H2O=Cr2O72-+8H+;(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+;根据常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH,加入氢氧化钠,调节溶液PH=8,可以生成Fe(OH)3、 Al(OH)3沉淀,所以过滤II操作得到的滤渣主要为Fe(OH)3、 Al(OH)3;根据元素守恒,滤液II中含有的离子主要有Na+、 SO42-、 CrO42-;(4)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,结合溶液中含有的阳离子,利用钠离子交换树脂可除去滤液II中的金属阳离子有Mg2+、 Ca2+;(5)Cr2O72-被SO2还原生成Cr(OH)(H2O)5SO4,反应离子方程式是2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH-。
2mol/L,v=54.3mL;配制时除量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有500mL容量瓶、胶头滴管;(2)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,Cr化合价升高,Cr3+是还原剂,则H2O2是氧化剂,反应离子方程式是2Cr3++3H2O2+H2O=Cr2O72-+8H+;(3)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+;根据常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH,加入氢氧化钠,调节溶液PH=8,可以生成Fe(OH)3、 Al(OH)3沉淀,所以过滤II操作得到的滤渣主要为Fe(OH)3、 Al(OH)3;根据元素守恒,滤液II中含有的离子主要有Na+、 SO42-、 CrO42-;(4)钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,结合溶液中含有的阳离子,利用钠离子交换树脂可除去滤液II中的金属阳离子有Mg2+、 Ca2+;(5)Cr2O72-被SO2还原生成Cr(OH)(H2O)5SO4,反应离子方程式是2CrO42-+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO42- +2OH-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g![]() Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应,下列叙述正确的是( )
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应,下列叙述正确的是( )
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
D. 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示从混合物中分离出X的两种方案,根据方案I和方案Ⅱ指出下列说法合理的是
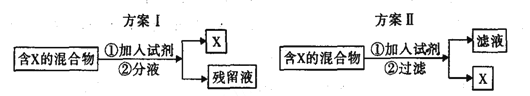
A.若含X的混合物为溴水,可通过方案I进行分离,加入试剂为CC14液体,充分振荡后液体分层,上层为X的CC14溶液
B.若含X的混合物为苯和苯酚,可通过方案Ⅱ进行分离,加入试剂为浓溴水,X为三溴苯酚
C.若含X的混合物为皂化反应后的混合物,可通过方案I进行分离,加入试剂为饱和食盐水,残留液中含有甘油
D.若含X的混合物为Fe、Al,可通过方案II进行分离,加入试剂为过量NaOH溶液,1mol X与足量氯气完全反应时,转移3mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
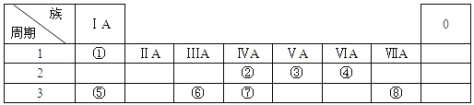
(1)化合物A是由⑤⑧两种元素构成的,用电子式表示其形成过程___________
(2)④、②元素形成的化合物的结构式__________
(3)②的最简单氢化物与氧气可以设计成燃料电池,写出在碱性条件下负极的电极方程式_____
(4)⑥的单质与⑤的最高价氧化物对应水化物的水溶液反应的离子方程式为:___________
(5)由①③⑧组成的M 物质中所含化学键的类型_________________
(6)M中的阳离子的鉴定方法是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是
A.在空气中敞口久置的浓硫酸,溶液质量增大(难挥发性)
B.在加热条件下铜与浓硫酸反应(强氧化性、酸性)
C.蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性)
D.浓硫酸干燥氯气(脱水性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程可以达到实验目的的是
编号 | 实验目的 | 实验过程 |
A | 配制0.4000 mol·L1的NaOH溶液 | 称取4.0 g固体NaOH于250 mL容量瓶中,加入蒸馏水溶解,定容至刻度线即可。 |
B | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
C | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
D | 制备Fe(OH)3胶体 | 通常是将Fe(OH)3固体溶于热水中即可 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
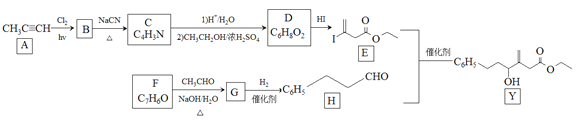
已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.镀锡的铁片镀层破损后,腐蚀速率加快
B.Fe在食盐水中被腐蚀,其负极反应为O2 +2H2O + 4e-=4OH-
C.可用被保护金属与直流电源负极相接的方法来减慢腐蚀速率
D.电解法精炼铜时,阳极材料应用粗铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关食品添加剂的说法中,正确的是( )。
A.山梨酸是一种常见的膨松剂
B.亚硝酸钠是一种常见的发色剂
C.碳酸氢钠具有碱性,是一种常见的调味剂
D.β胡萝卜素是一种人工食用色素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com