
| A、①④②③ | B、④①③② |
| C、①④③② | D、④①②③ |


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
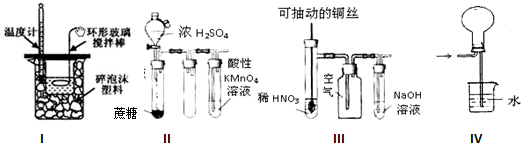
| A、实验I:中和热测定 |
| B、实验II:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
| C、实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D、实验IV:可用于HCl气体的吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所含溶质为NaHSO4的溶液:加入K+、CO32-、NO3-、Na+ |
| B、滴加酚酞变红的溶液:加入SO42-、Cu2+、K+、Cl- |
| C、常温下,加入铁粉能生成H2的溶液:加入Na+、Ca2+、Cl-、ClO- |
| D、含有大量SO42-的溶液:加入K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体硅是“信息革命“的支柱材料,可用作光导纤维 |
| B、将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
| C、化学反应伴随着能量的变化,反应物总能量一定大于生成物总能量 |
| D、含有碳的铜与稀H2SO4长时间接触会发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、缩小体积使压强增大 |
| B、体积不变充入CO2使压强增大 |
| C、体积不变充入He气使压强增大 |
| D、压强不变充入N2使体积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
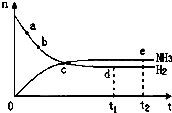 合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:
合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:| 催化剂 |
| 高温、高压 |
| A、点a的正反应速率比b点的大 |
| B、点c处反应还未达到平衡 |
| C、点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D、其他条件不变,500℃下反应至t1时刻,n(H2)比图中d点的值大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有电泳现象 |
| B、能全部通过滤纸 |
| C、能全部通过半透膜 |
| D、有丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20% | B、40% |
| C、60% | D、80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com