

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解

| Cu |
| △ |
| Cu |
| △ |


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

(1)实验室制取氨气的化学方程式为 ,工业上合成氨采取的下列措施中可用勒夏特列原理解释的是? ?(填字母)?
A.采用较高压强(20 Mpa~50 Mpa)?
B.采用500 ℃的高温?
C.用铁触媒作催化剂?
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2?
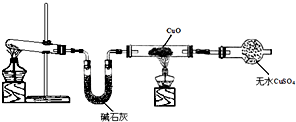
(2)适当改变如图所示的装置后,也可用来制取和收集氧气。改变的方法是: 。?
(3)实验室用浓硫酸和铜制取并收集少量的SO2气体,能否采用该装置 ? ?(填“能”或“不能”),若选填“能”,请说明理由;若选填“不能”,则怎样改变该装置后就能达到实验目的?请用文字说明 ;?
(4)取6.4 g铜片和12 mL 18.4 mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,某同学根据所学的化学知识认为还有一定量的硫酸剩余。下列药品能够用来证明反应结束后烧瓶中确实有余酸的是?? ??(填字母)。?
A.铁粉 B.氯化钡溶液? C.银粉 D.碳酸氢钠溶液?
(5)为定量测定余酸物质的量浓度,某同学进行了如下设计:先测定铜片与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。测定SO2的量的方案很多,下列方案可行的
是 (填字母)?
A.将装置中产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量?
B.将装置中产生的气体缓缓通入足量氢氧化钡溶液,反应完全后过滤、洗涤、干操、称量沉淀?
C.将装置中产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后过滤、洗涤、干燥、称量沉淀?
请对不可行的方案进行分析(可以不填满)
方案序号 | 分析 | 误差(偏高或偏低) |
|
|
|
|
|
|
|
|
|
(6)请再设计其他可行的实验方案来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)。??
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室制备干燥的NH3,根据图甲所示装置回答:
①反应的化学方程式为___________,实验中不选用NaOH制备NH3的原因是______________ ______________________________________,装置中收集NH3的试管口放置棉花团的作用是___________________________________________________________________。
②在a、c之间安装b,是否有必要?___________(填“有”或“没有”),若“有”,应装入___________试剂;(若“没有”,可不答此问)若“没有”,理由是_______________________________________。
(2)实验室欲快速制取大量NH3,根据图乙所示装置回答:
①用化学方程式表示,浓氨水滴入CaO中有大量NH3逸出的原理_______________________。
②检验NH3是否收集满的方法是_______________________________________________。
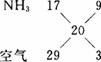
③测得用排空气法收集到一烧瓶NH3的质量是相同状况下相同体积的H2质量的10倍,若将该烧瓶中NH3做喷泉实验,实验完毕后,烧瓶中水约上升到烧瓶容积的__________(填“几分之几”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com