
 制备碳酸氢钠,然后用碳酸氢钠制备碳酸钠.
制备碳酸氢钠,然后用碳酸氢钠制备碳酸钠.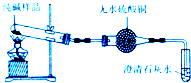
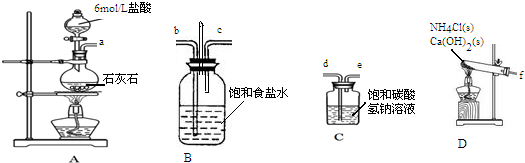
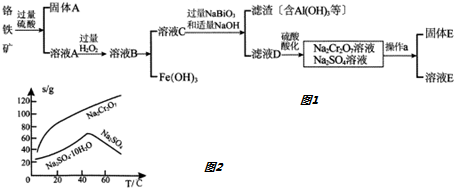
分析 Ⅰ.(1)我国著名化学家侯德榜发明的联合制碱法,主要原理是:向浓氨水(NH3•H2O)中通入足量的CO2,然后加入食盐充分搅拌,反应生成氯化铵和碳酸氢钠,由于碳酸氢钠的溶解度很小,以晶体形式析出,将析出的碳酸氢钠加热得碳酸钠、二氧化碳和水,利用装置A制备二氧化碳气体,利用装置C除去二氧化碳气体中的氯化氢气体,利用装置D制备氨气,氨气极易溶于水比空气轻,应从装置B的b管通入,二氧化碳比空气重,可以从导管c通入,二氧化碳、氨气、氯化钠和水反应生成碳酸氢钠和氯化铵;
(2)二氧化碳与水反应形成不稳定的碳酸,使水吸收二氧化碳量较少,而把二氧化碳通入溶有氨气而呈碱性的水中,会使生成的碳酸与氨水发生反应,而增大二氧化碳气体的吸收;
(3)利用碳酸氢钠制备纯碱时是利用固体加热,应在坩埚内对固体灼烧,使碳酸氢钠分解生成碳酸钠、二氧化碳和水,据此选择仪器;
(4)C装置是除去二氧化碳气体中的氯化氢杂质气体;
Ⅱ.(5)装置图中的试管中样品加热,碳酸氢钠分解生成二氧化碳、水蒸气和碳酸钠,通过无水硫酸铜,固体变蓝色检验有水生成,通过澄清石灰水溶液变浑浊;
(6)称取a g 样品置于小烧杯中,加水溶解,滴加足量的CaCl2溶液.充分反应后,过滤、洗涤、干燥,称得固体的质量为 m g,得到固体为碳酸钙沉淀,结合碳元素守恒计算碳酸钠的质量分数;
解答 解:Ⅰ.(1)利用装置A制备二氧化碳气体,利用装置C除去二氧化碳气体中的氯化氢气体,利用装置D制备氨气,氨气极易溶于水比空气轻,应从装置B的b管通入,二氧化碳比空气重,可以从导管c通入,二氧化碳、氨气、氯化钠和水反应生成碳酸氢钠和氯化铵,装置连接顺序为:adefb,
故答案为:de、b
(2)在制取NaHCO3时,先向饱和的NaCl溶液中通入较多的NH3,再通入足量的CO2的目的是先通入氨气,氨气与水形成呈碱性的氨水可与二氧化碳与水生成的碳酸发生反应,更有利于二氧化碳气体的吸收,提高二氧化碳溶解量增大产率,B中发生总反应的化学方程式:B中发生总反应的化学方程式:NH3+CO2+H2O+NaCl═NH4Cl+NaHCO3↓,
故答案为:提高二氧化碳溶解量增大产率;NH3+CO2+H2O+NaCl═NH4Cl+NaHCO3↓;
(3)利用碳酸氢钠制备纯碱时是利用固体加热,应在坩埚内对固体灼烧,使碳酸氢钠分解生成碳酸钠、二氧化碳和水,使用的仪器主要有三脚架、泥三角、坩埚钳、坩埚和酒精灯、玻璃棒,
故答案为:酒精灯、玻璃棒;
(4)C装置的作用是利用碳酸氢钠溶液吸收二氧化碳气体中的氯化氢,除去杂质净化作用,
故答案为:除去CO2中HCl;
Ⅱ.(5)装置图中的试管中样品如果混有碳酸氢钠,固体加热碳酸氢钠分解生成二氧化碳、水蒸气和碳酸钠,通过无水硫酸铜,固体变蓝色检验有水生成,通过澄清石灰水溶液变浑浊,
故答案为:澄清石灰水变浑浊;
(6)称取a g 样品置于小烧杯中,加水溶解,滴加足量的CaCl2溶液.充分反应后,过滤、洗涤、干燥,称得固体的质量为 m g,得到固体为碳酸钙沉淀,n(CaCO3)=$\frac{mg}{100g/mol}$=$\frac{m}{100}$mol,n(CaCO3)=n(Na2CO3)=$\frac{m}{100}$mol,结合碳元素守恒计算碳酸钠的质量分数=$\frac{\frac{m}{100}mol×106g/mol}{ag}$×100%=$\frac{53m}{50a}$×100%,故答案为:$\frac{53m}{50a}$×100%;
点评 本题考查了物质制备、物质性质、物质的组成探究和实验设计等,主要是侯氏制碱法原理、实验基本操作,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 液氨作为清洁能源的反应原理是4NH3+5O2$→_{△}^{催化剂}$4NO+6H2O | |
| B. | 液氨可以作为溶剂使用,而氢的沸点极低,不易液化 | |
| C. | 氨气比空气轻,标准状况下密度约为0.76 g•L-1 | |
| D. | 氨气与氢气相比,优点在于氨气不容易发生爆炸,使用时更安全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH3COONa中含有的共用电子对总数为8NA | |
| B. | 标准状况下,将22.4LCl2溶于水,反应转移电子数为NA | |
| C. | 450℃时,在催化剂的作用下,将2molSO2与一定量的O2混合反应,一段时间后测得SO2消耗了$\frac{1}{2}$,则该正反应消耗了NA个SO2分子 | |
| D. | 78gNa2O2和Na2S的混合物中含有的阴离子数目一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的最外层电子数比Y原子最外层电子数多 | |
| B. | X的最高价氧化物水化物的酸性比Y的最高价氧化物水化物的酸性强 | |
| C. | 与H2化合时X形成的单质比Y形成的单质容易 | |
| D. | X单质可以把Y从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
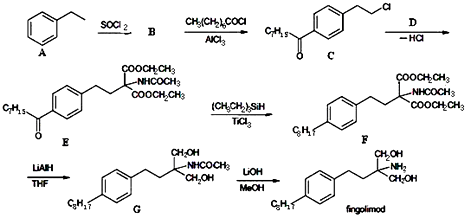
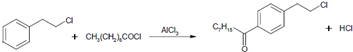 .
.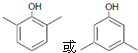 .
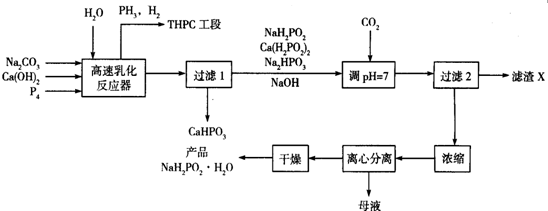
.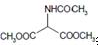 等主要原料,合成医药中间体:
等主要原料,合成医药中间体: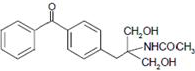 (无机原料任选).合成路线流程图示例如下:
(无机原料任选).合成路线流程图示例如下: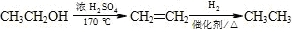
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com