
| A、H+、Cl-、CH3COO-、NO3- |
| B、K+、AlO2-、NO3-、OH- |
| C、Fe3+、I-、SO42-、H+ |
| D、AlO2-、HCO3-、Na+、K+ |
科目:高中化学 来源: 题型:
| A、1mol任何纯净物都含有相同的原子数 |
| B、1molO2中约含有6.02×1023个氧分子 |
| C、1mol水中含有8mol电子 |
| D、阿伏加德罗常数就是6.02×1023mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲为Fe丙为 Fe2O3 |
| B、甲为F2丙为O2 |
| C、甲为KH丙为 H2 |
| D、甲为CaC2丙为C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有1mol H-H键断裂,同时有1 mol I-I键形成 |
| B、容器内压强不再随时间而变化 |
| C、υ正(H2)=υ逆(HI) |
| D、H2、I2、HI的浓度之比为1:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
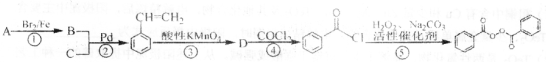
 ),在一定条件下能发生银镜反应,且1molE最多可得到4molAg;
),在一定条件下能发生银镜反应,且1molE最多可得到4molAg;查看答案和解析>>
科目:高中化学 来源: 题型:
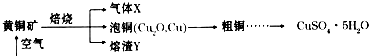
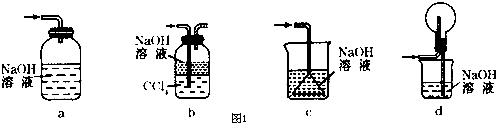
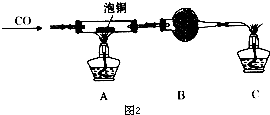
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com