
| A. | 1 mol OT-含有的质子数、中子数均为10NA | |
| B. | 25℃,101kPa时,4.90LNH3含有的分子数约为0.2NA | |
| C. | 常温常压下,6g二氧化硅中所含硅氧键数目为0.2NA | |
| D. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
分析 A.1个OT-含有9个质子,含有10个中子;
B.25℃,101kPa时,Vm≈22.4L/mol;
C.依据n=$\frac{m}{M}$计算物质的量,结合二氧化硅所含化学键为4个Si-O键计算;
D.二氧化锰只能与浓盐酸反应,稀盐酸和二氧化锰不反应.
解答 解:A.1 mol OT-含有的质子数9NA、中子数均为10NA,故A错误;
B.25℃,101kPa时,Vm略大于22.4L/mol,4.90LNH3含有的分子物质的量约为0.2mol,所含分子数约为0.2NA,故B正确;
C.6g二氧化硅物质的量=$\frac{6g}{60g/mol}$=0.1mol,二氧化硅所含化学键为4个Si-O键,6g二氧化硅含有Si-O键数目为0.4NA,故C错误;
D.二氧化锰只能与浓盐酸反应,一旦浓盐酸变稀,反应即停止,4molHCl反应时转移2mol电子,而50mL12mol/L盐酸的物质的量n=CV=12mol/L×0.05L=0.6mol,这0.6mol盐酸不能完全反应,则转移的电子的物质的量小于0.3mol电子,即小于0.3NA个,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,注意二氧化硅的结构,题目难度中等.


科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 其他条件不变,向平衡体系中再充入0.32molA,再达到新平衡时,B的转化率增大 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正) | |
| C. | 其他条件不变,起始时向容器中充入0.64molA和B,平衡时,n(C)<0.48mol | |
| D. | 反应前2min的平均速率ν(C)=0.004mol•(L•min)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 检验方法 | 结论 |
| A | 向一种未知溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味的气体 | 未知溶液中一定含有CO${\;}_{3}^{2-}$ |
| B | 向一种未知溶液中滴加NaOH溶液,产生白色沉淀 | 未知溶液中一定含有Al3+ |
| C | 向一种未知溶液中先加入盐酸酸化,再加AgNO3溶液,有白色沉淀生成 | 未知溶液中一定含有Cl- |
| D | 用洁净的铂丝蘸取一种未知液在酒精灯外焰上灼烧火焰呈黄色 | 不能确定未知溶液中一定没有含K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO${\;}_{3}^{-}$、OH-、Cl- | B. | Fe2+、OH-、NO${\;}_{3}^{-}$ | ||
| C. | Fe2+、H+、Cl- | D. | Na+、H+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的强酸溶液1mL,加水稀释至100mL后,溶液pH降低2个单位 | |
| B. | pH=2的盐酸中水电离出的H+浓度小于pH=12的氨水中水电离出的OH-浓度 | |
| C. | 0.2molCO2通入1L0.3mol•L-1KOH溶液中:2c(H+)+c(HCO3-)+3c(H2CO3)=2c(OH-)+c(CO32-) | |
| D. | 已知一定浓度的NaHSO3溶液pH=5.4,则c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
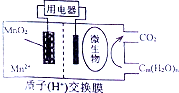
| A. | MnO2极为负极 | |
| B. | Cn(H2O)m发生了氧化反应 | |
| C. | 电子从负极区经交换膜移向正极区 | |
| D. | 放电过程中,H+从正极区移向负极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | CuO | C. | Cu(OH)2 | D. | Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 欲配制500mL 0.5mol•L-1的NaOH溶液,试回答下列问题.
欲配制500mL 0.5mol•L-1的NaOH溶液,试回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com