
【题目】下列反应能用![]() 来表示的是
来表示的是![]()
![]()
A. 澄清石灰水与![]() 溶液反应 B.
溶液反应 B. ![]() 和
和![]() 溶液反应
溶液反应
C. NaOH溶液和![]() 溶液反应 D.
溶液反应 D. ![]() 溶液和HI溶液反应
溶液和HI溶液反应
科目:高中化学 来源: 题型:
【题目】关节炎的成因是在关节滑液中形成尿酸钠晶体——NaUr,其平衡关系为:Ur—(aq)+Na+(aq) ![]() NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
A. 形成尿酸钠晶体的反应为放热反应 B. 形成尿酸钠晶体的反应为吸热反应
C. 尿酸钠溶解度较大 D. 尿酸钠晶体一定难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗是重要的稀缺战略资源,广泛应用于众多国防军工及民用领域,属于我国战略收储金属。某科研课题采用的提取锗技术路线为:低品位锗精矿-(次亚磷酸钠热还原-真空挥发富集)-挥发产物高品位还原锗精矿-碱氧化预处理-盐酸蒸馏提纯-高纯四氯化锗-高纯二氧化锗。

(1)在周期表中金属与非金属的分界处,可以找到半导体材料,如Si、 等,半导体器件的研制正是开始于 ,后来发展到研制与它同族的 。三种元素依次是_______(填标号)。
a.Ge Si Ge
b.Ge Ge Si
c.C Si Ge
(2)请配平次亚磷酸钠热还原反应的化学方程式并在括号内注明反应条件:
___NaH2PO2·H2O+GeO2 ![]() ___Na4P2O7+___H2O+___GeO↑+___H3PO4,_____________
___Na4P2O7+___H2O+___GeO↑+___H3PO4,_____________
(3)高品位还原锗精矿碱氧化预处理过程的产物是锗酸钠,请写出该过程的化学反应方程式:____________________________________________
(4)高纯二氧化锗含量采用碘酸钾滴定法进行分析。称取3.600g高纯二氧化锗样品,采用氢氧化钠在电炉上溶样,次亚磷酸钠加热还原,然后以淀粉为指示剂,用碘酸钾标准溶液(0.6000mol/L)滴定,消耗的碘酸钾体积为19.00mL。[20℃以下,次亚磷酸钠不会被碘酸钾和碘氧化]
①滴定终点的现象是_____________________________。
②此样品中二氧化锗含量是_________。(保留四位有效数字)
(5)用氢气还原GeO2可制得金属锗。其反应如下:
GeO2+ H2= GeO+ H2O ①
GeO+ H2= Ge+ H2O ②
GeO2+ 2H2= Ge+ 2H2O ③
反应式③ΔH=+13750 kJ/mol ,ΔS=+15600J/(K·mol),则还原反应的温度一般控制在_________℃范围内。[已知GeO在700℃会升华,T(K)=t(℃)+273]
(6)锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有一最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时_________加剧所致。
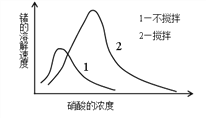
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,1体积水中能溶解500体积的HCl气体。若向水中通入标准状况下的44.8 L HCl气体配成1 L溶液,假设气体完全溶解,所得溶液中含HCl的物质的量浓度为________;若所得溶液密度为1.1 g·cm-3,则溶液中含HCl的质量分数为________;从该溶液中取出10 mL浓盐酸溶解于水中配制成250 mL溶液,配制后的稀溶液中含HCl物质的量浓度为________。在用浓盐酸配制上述稀盐酸时,所用仪器中,使用前必须检查是否漏液的仪器有________;配制过程中,造成浓度偏低的操作可能有________(选填下列操作的序号)。
A.容量瓶用蒸馏水洗后未加干燥
B.量筒用蒸馏水洗后未干燥
C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯和玻璃棒,即向容量瓶中加水到刻度
D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚好达刻度线
E.定容时,俯视液面加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是

A. 反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的ΔH>0
CO2(g)+H2(g)的ΔH>0
B. 在T2时,若反应处于状态D,则一定有ν正<ν逆
C. 平衡状态A与C相比,平衡状态A的c(CO)小
D. 若T1、T2时的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)2 mol CO(NH2)2中含________mol H,所含氧原子跟________mol H2O所含氧原子个数相等。
(2) 2 mol O3和3 mol O2的质量之比为________,同温同压下的密度之比为________,含氧原子数之比为________。
(3)在9.5 g某二价金属的氯化物中含有0.2 mol Cl-,此氯化物的摩尔质量为__________,该金属元素的相对原子质量为____________。
(4)6.72 L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车安全气囊中填充叠氮酸钠![]() 和硝酸钾
和硝酸钾![]() 。汽车发生猛烈撞击时,
。汽车发生猛烈撞击时,![]() 会迅速分解产生
会迅速分解产生![]() 和Na,Na单质可与
和Na,Na单质可与![]() 继续反应。完成下列填空:
继续反应。完成下列填空:
![]() 原子最外层电子的电子排布式为______,氮气的电子式为______。
原子最外层电子的电子排布式为______,氮气的电子式为______。
![]() 请将
请将![]() 、
、![]() 、
、![]() 按照离子半径由大到小的顺序排列______
按照离子半径由大到小的顺序排列______![]() 填离子符号
填离子符号![]() 。
。
![]() 的金属性强于Na,用一个事实说明______。
的金属性强于Na,用一个事实说明______。
![]() 配平Na与
配平Na与![]() 反应的化学方程式,并标出电子转移的方向与数目:
反应的化学方程式,并标出电子转移的方向与数目:
______![]() ______
______![]() ______
______![]() ______
______![]() ,若标准状况下生成
,若标准状况下生成![]() 氮气,转移的电子数目为______
氮气,转移的电子数目为______![]() 。
。
![]() 请解释
请解释![]() 晶体比
晶体比![]() 晶体熔点低的原因______。
晶体熔点低的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下列相关说法正确的是______________
A.通过某种电池单位质量或单位体积所能输出能量的多少,来判断该电池的优劣
B.二次电池又称充电电池或蓄电池,这类电池可无限次重复使用
C.除氢气外,甲醇、甲烷、乙烷等都可用作燃料电池的燃料
D.近年来,废电池必须进行集中处理的问题被提到议事日程,其首要原因是电池外壳的金属材料需要回收
(2)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:
Cd+2NiO(OH)+2H2O ![]() 2Ni(OH) 2+Cd(OH)2
2Ni(OH) 2+Cd(OH)2
已知Ni(OH) 2和Cd(OH) 2均难溶于水,但能溶于酸,下列说法正确的是:_____
A.以上反应是可逆反应 B.反应环境为碱性
C.电池放电时Cd作负极 D.该电池是一种二次电池
(3)航天技术中使用的氢氧燃料电池具有高能、轻便和无污染的优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均为:2H2+O2===2H2O。
①碱式电池中的电解质是KOH,其负极反应式为2H2-4e-+4OH-===4H2O,则其正极反应可表示为________________,电池工作一段时间后,电解质溶液的pH__________(填“增大”“减小”或“不变”)。
②若该电池为飞行员提供了36 kg的水,则电路中通过了_______mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com