
(1)在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
A.Li,F B.Na,F C.Na,C1 D.Mg,O
【答案】B
【解析】金属性最强和非金属性最强的元素形成共价键的可能最小.
(2)下列有关物质性质、结构的表述均正确,且存在因果关系的是:
| 表述Ⅰ | 表述Ⅱ | |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中C1—与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比PbH4分子稳定性高 | Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
| C | 在形成化合物时,同一主族元素的化合价相同 | 同一主族元素原子的最外层电子数相同 |
| D | P4O12、C6H12O6溶于水后均不导电 | P4O12、C6H12O6均属于共价化合物 |
【答案】B
【解析】A不存在因果关系; C选项形成化合物时,同一主族元素的化合价不一定相同;D选项表述1错误.
(3)下列说法中错误的是:
A.SO2、SO3都是极性分子B.在NH4+ 和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
 答案:A
答案:A
解析:平面三角形分子,键角120度,因此它是非极性分子.
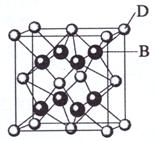
(4)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。请回答:
(1)A元素的名称是 ;
(2)B的元素符号是 ,C的元素符号是 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(3)E属元素周期表中第 周期,第 族的元素,其元素名称是 ,
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合 物晶体的密度为ag·cm-3,则晶胞的体积是 (只要求列出算式)。
【答案】(1)氢 (2)F Cl HF分子间存在氢键
(3)4 VIIB 锰 (4)CaF2 78×4/aNA
【解析】突破口在E,是周期表中1—18列中的第7列元素, 又前36号的元素,基本推知E为25号元素Mn,这样依题意D为Ca,根据晶胞结构利用均摊法可知该晶胞中有4个D,8个B.推知BD形成D(B)2物质,这样说明B位于第VIIA族,加上B和C属同一主族,可知B为F,C为Cl. A与其他4种元素既不在同一周期又不在同一主族只能是H.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
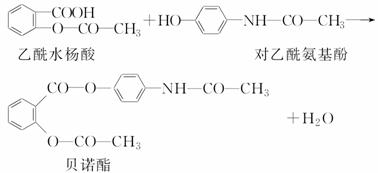
下列有关叙述正确的是( )
A.贝诺酯分子中有三种含氧官能团
B.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚[来源:学科网ZXXK]
C.乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D.贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是
( )
A.乙醛分子中的所有原子都在同一平面上
B.凡是能发生银镜反应的有机物都是醛
C.醛类既能被氧化为羧基,又能被还原为醇
D.完全燃烧等物质的量的乙醛和乙醇,消耗氧气的质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表1信息,判断以下叙述正确的是( )
表1 部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.122 | 0.124 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外加电场的作用下金属产生自由电子,电子定向运动
C.分子晶体的熔沸点低,常温下均呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为12,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是( )
A.原子半径:A<B<C
B.A的氢化物稳定性大于C的氢化物稳定性
C.三种元素的最高价氧化物对应水化物均可由化合反应得到
D.高温下,A单质能置换出C单质
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四种相邻短周期元素(如下图所示),根据元素性质递变规律,回答下列问题:
⑴A和C元素;B和D元素各有相似的化学性质,是因为:
。
⑵氧与硫处于同一族,性质相似,对应的化合物也有类似的性质,同时有差异,如:H2O与H2S; CH3CH2OH与CH3CH2SH(乙硫醇)等有一定相似性。请回答下列问题:
① 已知酸性H2O<H2S,试判断乙醇和乙硫醇分别与金属钠反应的剧烈程度
CH3CH2OH CH3CH2SH(填>、<或=)
②CH3CH2Br不仅能与NaOH溶液反应,而且也能与NaHS溶液反应,则化学反应方程式为:
⑶在四种元素中A元素还可能与D元素有相似的化学性质,化学上称为对角线规则。请完成下列反应方程式:(已知:镁可以在氮气中燃烧得到氮化镁)
①Li单质也能在氮气中燃烧,其化学反应方程式为: 。
②铍单质与氢氧化钠溶液反应的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
H2SO4和HNO3的浓度分别为4mol/L和2mol/L的混合液,取10mL加入过量的铁粉,若HNO3的还原产物为NO,则生成气体在标况下的总体积为 ( )
A.0.224L B.0.672L C.0.112L D.0.336L
查看答案和解析>>
科目:高中化学 来源: 题型:
已知一定温度和压强下,在起始容积为V L的容器中充入1 mol A和1 mol B,保持恒温恒压下反应:A(g)+B(g)  C(g) △H>0。达到平衡时,C的体积分数为40%。试回答:
C(g) △H>0。达到平衡时,C的体积分数为40%。试回答:
(1)升温时,C的反应速率 (填“加快”、“减慢”或“不变)。
(2)若使温度、压强在上述条件下恒定不变,平衡时在密闭容器中继续充入2 mol A和2 mol B,则反应再次达到平衡时,C的体积分数是
(3)若反应在恒温恒容条件下进行并达到平衡,保持其他条件不变,向容器中通入稀有气体,请在右图中画出通入稀有气体后的正逆反应速率随时间的变化图像,并标出v(正)、v(逆)及其关系。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com