
【题目】食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________(只填化学式)。
②分离操作①中所用到的玻璃仪器有____________。
③洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________。
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)在实验中多次用到玻璃棒,其作用有三个,分别是______________、______________、______________。
【答案】BaCl2、NaOH、Na2CO3(或NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH) 玻璃棒、漏斗、烧杯 75%乙醇 天平、500 mL容量瓶、胶头滴管 搅拌 引流 转移
【解析】
(1)除去粗盐中的可溶性杂质:Ca2+、Mg2+、Fe3+、SO42-,往往把杂质转化为沉淀除去,除钙离子用碳酸根,除镁离子和铁离子用氢氧根,除硫酸根用钡离子,要注意除杂质的顺序,后加的试剂最好能把前面先加是过量试剂除掉;
②根据流程图,分离操作①为过滤;
③根据提供的试剂,利用氯化钠微溶于乙醇且乙醇易挥发分析解答;
(2)根据配制一定物质的量浓度溶液的步骤分析需要的仪器;
(3)在本实验中用到玻璃棒的操作有:过滤、溶解、蒸发结晶,据此分析解答。
(1)①除去粗盐中的可溶性杂质:Ca2+、Mg2+、Fe3+、SO42-,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子和多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序,故答案为:BaCl2、NaOH、Na2CO3(或NaOH、BaCl2、Na2CO3或BaCl2、Na2CO3、NaOH);
②分离操作①为过滤,所用到的玻璃仪器有玻璃棒、漏斗、烧杯,故答案为:玻璃棒、漏斗、烧杯;
③氯化钠微溶于乙醇且乙醇易挥发,洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为75%乙醇,故答案为:75%乙醇;
(2)用天平称量药品,用烧杯溶解药品,用500mL容量瓶配制溶液,用胶头滴管定容,所以需要的仪器还有:天平、500mL容量瓶、胶头滴管,故答案为:天平、500mL容量瓶、胶头滴管.
(3)在“粗盐提纯”的实验中,多次用到玻璃棒,在溶解时的作用为搅拌加速溶解,在过滤操作中作用为引流,在蒸发操作中的进行搅拌,防止液体局部过热使液体飞溅并转移药品,故答案为:搅拌;引流;转移。


科目:高中化学 来源: 题型:
【题目】钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。一种制备草酸钴晶体(CoC2O4·2H2O)的工艺流程如下
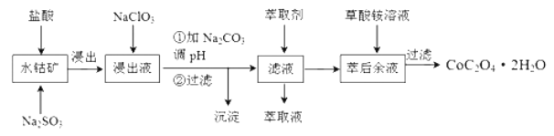
已知:①水钴矿主要成分为Co2O3、Co(OH)3;还含有少量Fe2O3、Al2O3、MnO等杂质。
②浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等
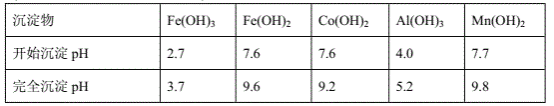
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(金属离子浓度以0.01mol·L-1计)
(1)写出浸出过程中Co(OH)3发生反应的离子方程式:______________________________。
(2)NaClO3的作用是_____________________________________________。
(3)加Na2CO3调pH的范围应该在_______________间,a加入萃取剂的目的是______________________________。
(4)在空气中加热5.49g草酸钻晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
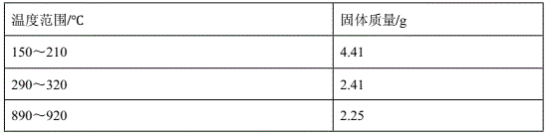
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是_____________________________________________。[M( CoC2O4·2H2O)=183g/mol]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)现有下列状态的物质:①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融KOH ⑧盐酸。其中能导电的是__________,(填序号,下同),属于电解质的是___________,属于非电解质的是___________。
(2)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系是________
(3)在同温、同压下,实验测得CO、N2和SO2三种气体的混合气体的密度是H2的20倍,其中SO2的体积分数为______;若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于加成反应的是( )
A.乙烯通入酸性高锰酸钾溶液中,溶液褪色
B.苯滴入溴水中,振荡后溴水层接近无色
C.甲烷和氯气混合后,放置在光亮的地方,混合气体颜色逐渐变浅
D.将裂化获得的汽油滴入溴水中,溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 含有非极性键的分子一定是非极性分子
B. 非极性分子中一定含有非极性键
C. 由极性键形成的双原子分子一定是极性分子
D. 两个原子之间共用两对电子,形成的化学键一定有极性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖表彰了两项成果,其中一项是瑞士科学家库尔特·维特里希“发明了利用核磁共振技术测定溶液中生物大分子三维结构的方法”。在化学上经常使用的是氢核磁共振谱,它是根据不同化学环境的氢原子在氢核磁共振谱中给出的信号不同来确定有机物分子中氢原子种类的。下列有机物分子中,在氢核磁共振谱中信号强度(个数比)是1:3的是
A. 1,2,3-三甲基苯 B. 丙烷
C. 异丙醇 D. 甲酸叔丁酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。下列说法错误的是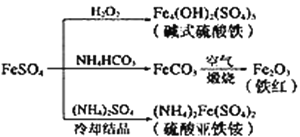
A. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中不正确的是
A. 标况下,22.4 L氧气的分子数为NA
B. 100 g质量分数为98%的浓硫酸中所含氧原子数为4NA
C. 常温常压下,42 g C2H4和C3H6的混合气体含有的H原子数为6NA
D. 18 g NH4+含有的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol·L-1NaOH溶液滴定新配制的25.0mL0.02 mol·L-1FeSO4溶液,应用手持技术测定溶液的pH与时间(t)的关系,结果如右图所示。下列说法错误的是
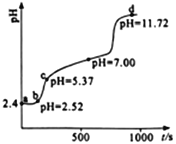
A. ab段,溶液中发生的主要反应:H++OH-=H2O
B. bc段,溶液中c(Fe2+) > (Fe3+) >c(H+)>c(OH-)
C. d点,溶液中的离子主要有Na+、SO42-、OH-
D. 滴定过程发生了复分解反应和氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com