
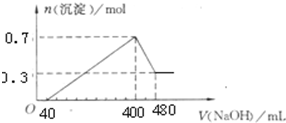
 将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.计算:
将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.计算: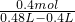 =5mol/L.
=5mol/L.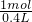 =2.5mol/L,
=2.5mol/L,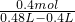 =5mol/L.
=5mol/L. 计算;
计算;

科目:高中化学 来源: 题型:
 将一定质量的Mg和Al的混合物投入250mL、2.0mol/L稀硫酸中,固体全部溶解并产生气体0待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入250mL、2.0mol/L稀硫酸中,固体全部溶解并产生气体0待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 (2009?长春一模)将一定质量的Mg和Al的混合物投入1mol?L-1500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
(2009?长春一模)将一定质量的Mg和Al的混合物投入1mol?L-1500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定质量的Mg和Al混合物投入500mL 稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al混合物投入500mL 稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
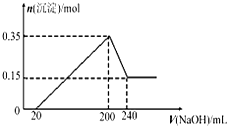 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示,则下列说法不正确的是( )
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示,则下列说法不正确的是( )| A、Mg和Al的总质量为9g | B、生成的H2在标准状况下的体积为11.2L | C、NaOH溶液的物质的量浓度为5mol/L | D、硫酸的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源:2015届天津市高一上学期期末考试化学试卷(解析版) 题型:选择题
将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是

A.Mg和Al的总质量为9g
B.最初20mLNaOH溶液用于中和过量的稀硫酸
C.NaOH溶液物质的量浓度为5mol·L-1
D.生成的氢气在标准状况下的体积为11.2L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com