
(1)A、B、C、D、E、F是元素周期表前四周期的元素,它们在元素周期表中的位置如图所示:
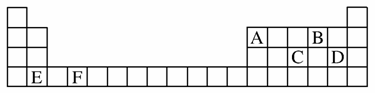
①写出F的基态原子的核外电子排布式:___________________________________________
________________________________________。
②C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是____________________。
(2)A、B、C 3种元素中,A的第一电离能最小,C的电负性最大,3种元素的失电子能力由强到弱的顺序为
___________________________________________。
(3)D、E两种元素形成的化合物化学式为____________________。
解析 (1)根据题给周期表可知,A为硼元素,B为氧元素,C为磷元素,D为氯元素,E为钙元素,F为钛元素。磷原子的最外层电子排布式为3s23p3,处于半充满,它比相邻两元素的第一电离能都高。
(2)原子的电离能越小,失电子能力越强;原子的电负性越大,得电子能力越强,失电子能力越弱。硼的第一电离能最小,因此硼失电子能力最强;氧的电负性最大,因此氧的失电子能力最弱,其顺序为A>C>B(或B>P>O)。
(3)E与D形成的化合物为CaCl2。
答案 (1)①1s22s22p63s23p63d24s2 ②磷原子的最外层电子排布式3s23p3,它处于半充满稳定状态
(2)A>C>B (填B>P>O也可)
(3)CaCl2


 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是( )
A.原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物不能发生反应
C.X的最高价氧化物对应的水化物的酸性比W的弱
D.Y的气态简单氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.SiH4比CH4稳定
B.O2-半径比F-的小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
乙烯可以催熟果实,为了延长果实的寿命,便于长距离运输,人们在装有果实的密闭容器内放入浸泡过某种溶液的硅藻土,用来吸收果实产生的乙烯。该溶液最可能是( )
A.NaCl溶液 B.NaOH溶液
C.溴水 D.KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
将下列仪器组成一套实验室蒸馏石油的装置,并进行蒸馏,可以得到汽油和煤油。
(1)下图中A、B、C三种仪器的名称分别是____________________________________________________________________________________________。

(2)将上图仪器按顺序连接为一整套装置:e接( );( )接( );k接( );( )接( );( )接( )。(填字母)
(3)A仪器中c口用于________,d口用于________。
(4)蒸馏时,温度计水银球应在__________________________________位置。
(5)在B中注入石油后,加几片碎瓷片的目的是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
酚酯的合成方法之一是由酚与酰卤(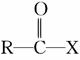 )反应制得。
)反应制得。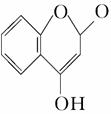 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
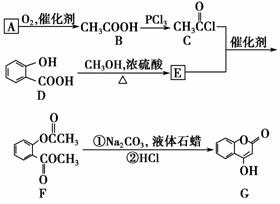
(1)A与银氨溶液反应有银镜生成,则A的结构简式是
______________________________________________。
(2)B―→C的反应类型是________。
(3)E的结构简式是___________________________________________。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:__________________
_______________________________________________________。
(5)下列关于G的说法正确的是________(填序号)。
a.能与溴单质反应
b.能与金属钠反应
c.1 mol G最多能和3 mol氢气反应
d.分子式是C9H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐是人类生活中不可缺少的物质,海水中含有大量食盐。
某地出产的粗盐中,所含杂质是CaCl2,通过下面的实验可制得纯净的NaCl2。
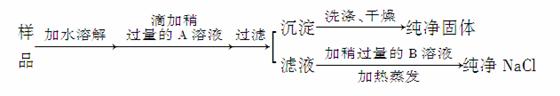 请回答:
请回答:
(1)加入的A是__________,检验A已过量的方法是_________________________
________________________________________________________________________。
(2)加入的B是__________,加入稍过量B的目的是________________________。
(3)为检验沉淀是否洗净,最好在最后几滴洗出液中加入______________________溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com