
分析 (1)读取读数时仰视,导致KMnO4溶液体积偏大,计算测定的草酸的质量偏大;
(2)依据滴定发生的氧化还原反应离子方程式的定量关系计算得到.
解答 解:(1)读取读数仰视,导致KMnO4溶液体积偏大,计算测定的草酸的质量偏大,故x的值偏小,故答案为:偏小;
(2)由题给化学方程式及数据可知,5H2C2O4+2MnO4-+6 H+═10CO2↑+2 Mn2++8 H2O,7.56g纯草酸晶体中含H2C2O4的物质的量为:0.600 mol/L×10.00 mL×10-3 L/mL×$\frac{5}{2}$×$\frac{100ml}{25ml}$=0.0600 mol,
则7.56g H2C2O4•xH2O中含H2O的物质的量为$\frac{7.56g-0.0600mol×90g/mol}{18g/mol}$=0.12 mol,0.0600mol晶体含水0.160mol,1mol晶体中含的结晶水2mol,则x=2.
故答案为:2.
点评 本题考查中和滴定实验,难度适中,注意掌握草酸含量的计算方法及中和滴定中的误差分析即可解答.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LCH3Cl含极性共价键数目为2NA | |
| B. | 0.1L 1.0mol/L Na2S溶液中S2-和HS-总数为0.1NA | |
| C. | 22.4g 铁粉与稀硝酸完全反应时转移的电子数一定为1.2NA | |
| D. | 常温常压下,16g14CH4中所含电子数目为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①④ | C. | ②③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
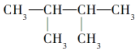 的系统命名为2,3-二甲基丁烷;
的系统命名为2,3-二甲基丁烷;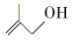 的分子式为C4H8O;
的分子式为C4H8O;查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中化学能转化成了电能 | ||
| C. | 甲中铜片是负极 | D. | 乙中铜片是正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Al3+、NH4+、Cl-、HCO3- | |
| B. | 甲基橙显红色的溶液中:Fe2+、Na+、SO42-、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol•L-1的溶液:K+、HCO3-、I-、ClO- | |
| D. | pH值为1的溶液:Fe2+、Cl-、Na+、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
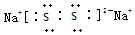 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com