
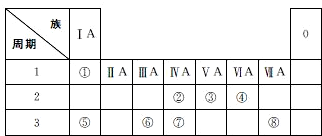
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑪ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.分析 由元素在周期表中的位置可知,①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为C、⑦为Cl、⑧为Ar、⑨为K、⑩为Br、⑪为Si,
(1)稀有气体Ar最不活泼,原子核外有18个电子,有3个电子层,各层电子数为2、8、8;
(2)地壳中含量较多的元素依次是氧、硅、铝、铁,其中铝、铁是金属元素;元素⑥为碳,CH4是最简单的有机化合物;
(3)元素周期表右上方的非金属性最强,0族元素除外,但元素最高价氧化物的水化物中高氯酸是最强酸,最强的含量K的金属性最强,其最高价氧化物对应水化物的碱性最强;氢氧化铝是两性氢氧化物;
(4)③、④、⑤均为金属元素,金属越活泼,对应阳离子的氧化性越弱,Al是其中金属性最弱的金属元素;②、⑦、⑩对就的氢化物依次为HF、HCl、HBr,其水溶液的酸性依次增强,其中HF为弱酸,其余均为强酸;
(5)Al与氢氧化钠溶液反应生成偏铝酸钠与氢气.
解答 解:由元素在周期表中的位置可知,①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为C、⑦为Cl、⑧为Ar、⑨为K、⑩为Br、⑪为Si;
(1)稀有气体Ar最不活泼,原子核外有18个电子,有3个电子层,各层电子数为2、8、8,原子结构示意图为: ,
,
故答案为: ;
;
(2)Al是地壳中含量最高的金属元素,碳的最简单氢化物为CH4,故答案为:Al;CH4;
(3)氯元素最高价氢化物对应水化物HClO4是最强酸,K的金属性最强,KOH碱性最强;氢氧化铝是两性氢氧化物,故答案为:HClO4;KOH;Al(OH)3;
(4)Na、Mg、Al三种金属元素对应阳离子氧化性由强到弱的顺序为Al3+>Mg2+>Na+;F、Cl、Br三种元素的氢化物水溶液酸性由强到弱的顺序为HBr>HCl>HF;故答案为:Al3+>Mg2+>Na+;HBr>HCl>HF;
(6)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
点评 本题考查元素周期表与元素周期律综合应用,难度不大,注意整体把握元素周期表结构,熟练掌握基础知识.


科目:高中化学 来源: 题型:实验题
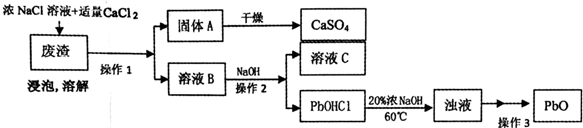
NaCl浓度(g/L)温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | 180 | 260 | 300 |
| 13 | 7 | 3 | 1 | 0 | 0 | 0 | 3 | 9 | 13 |
| 50 | 11 | 8 | 4 | 3 | 4 | 5 | 10 | 21 | 35 |
| 100 | 21 | 17 | 11 | 12 | 13 | 15 | 30 | 65 | 95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
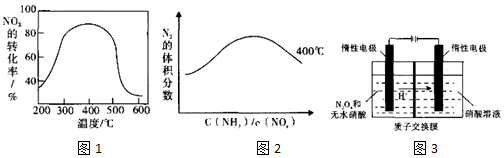
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应生成了1.12L(标准状况)H2 | |
| B. | 向反应后的溶液中加入足量小苏打,最终有白色沉淀生成 | |
| C. | 在反应后的溶液中一定能大量共存的粒子有:K+、Mg2+、I-、NO3- | |
| D. | 向反应后的溶液中加入足量稀硫酸,最终有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{3n+2}{2}$ | B. | $\frac{3n-2}{2}$ | C. | $\frac{2n-2}{3}$ | D. | n+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
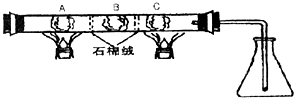 在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.
在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和H2SO4 | B. | AlC13和NaOH | C. | NaAlO2和H2SO4 | D. | NaHCO3和Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
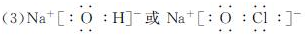 .
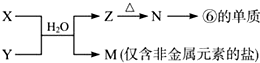
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com