
【题目】“垃圾是放错了位置的资源”,应该分类回收。某化学兴趣小组拟采用如下处理方法回收废电池中的资源。
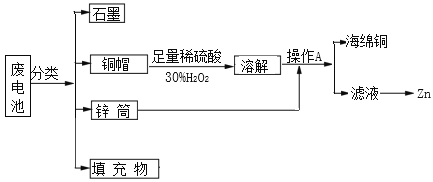
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+ Zn(OH)2,其正极的电极反应式为_________。
(2)铜帽溶解时加入H2O2的目的是___________________ (用化学方程式表示)。铜帽溶解完全后,可采用________ 方法除去溶液中过量的H2O2。
(3)填充物中可以回收得到氯化铵,写出氯化铵溶液中各离子浓度的大小顺序______。
(4)铜器在潮湿环境中发生的电化学腐蚀如图所示:
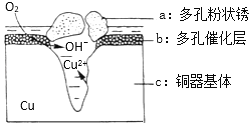
环境中的Cl﹣扩散到孔口,并与正极反应产物和负极产物作用生成多孔粉状锈Cu2(OH)3Cl,其若生成4.29g Cu2(OH)3Cl,则理论上消耗氧气体积为______L(标准状况)。
【答案】MnO2+e-+H2O=MnOOH+OH- Cu+H2O2+H2SO4=CuSO4+2H2O 加热 c(Cl-)>c(NH![]() )>c(H+)>c(OH-) 0.448
)>c(H+)>c(OH-) 0.448
【解析】
在碱性锌锰干电池中,电极为锌和碳棒,电解质为KOH,在负极:Zn-2e- +2OH- =Zn(OH)2,在正极:2MnO2+2e-+2H2O=2MnOOH+2OH-,所以废电池中,电池周围被锌筒包围,中间有碳棒,碳棒上有铜帽,填充物为MnO2、NH4Cl、MnOOH、 Zn(OH)2等。将它们分离后,铜帽加入足量稀硫酸和30%H2O2,发生反应Cu+H2O2+H2SO4=CuSO4+2H2O,溶解后加入锌筒,发生反应Zn+Cu2+=Zn2++Cu,然后过滤,得到海绵铜和含有Zn2+的滤液。
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+ Zn(OH)2,其正极的电极反应式为MnO2+e-+H2O=MnOOH+OH-。答案为:MnO2+e-+H2O=MnOOH+OH-;
(2)铜帽溶解时加入H2O2的目的,是将Cu氧化并最终转化为CuSO4,发生反应的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O。因为H2O2受热后易分解生成氧气和水,所以铜帽溶解完全后,可采用加热方法除去溶液中过量的H2O2。答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;加热;
(3)填充物中可以回收得到氯化铵,在氯化铵溶液中发生如下电离与水解:NH4Cl=NH4++Cl-,NH![]() +H2O
+H2O![]() NH3·H2O + H+,H2O
NH3·H2O + H+,H2O![]() H++OH-,所以各离子浓度的大小顺序c(Cl-)>c(NH
H++OH-,所以各离子浓度的大小顺序c(Cl-)>c(NH![]() )>c(H+)>c(OH-)。答案为:c(Cl-)>c(NH
)>c(H+)>c(OH-)。答案为:c(Cl-)>c(NH![]() )>c(H+)>c(OH-);
)>c(H+)>c(OH-);
(4)铜器在潮湿环境中发生电化学腐蚀,负极2Cu-4e-=2Cu2+,正极O2+4e-+2H2O=4OH-,环境中的Cl﹣扩散到孔口,并与正极反应产物和负极产物作用生成多孔粉状锈Cu2(OH)3Cl,发生反应的离子方程式为2Cu2++3OH-+Cl-= Cu2(OH)3Cl↓,由此可得出关系式:2Cu——O2——Cu2(OH)3Cl,若生成4.29g Cu2(OH)3Cl,则理论上消耗氧气体积为![]() =0.448L。答案为:0.448。
=0.448L。答案为:0.448。


科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l)△H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
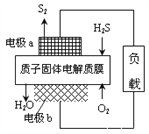
A. 电池在工作时,电流从电极a经过负载流向电极b
B. 电极a上发生的电极反应为: 2H2S - 4e- = S2 + 4 H+
C. 当反应生成64gS2时,电池内部释放632kJ热量
D. 当电路中通过4mol电子时,有4mol H+经质子膜进入负极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个制取氯气并以氯气为原料进行特定反应的装置。
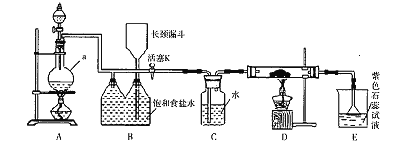
(l)A是氯气发生装置,写出其中的化学反应方程式___________。
(2)a仪器的名称为___________。
(3)实验开始时,先点燃A处的酒精灯,打开活塞K,让氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式_________,装置C的作用是__________。
(4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为_______。
(5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为___________(填序号)。
①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。
(6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,则装置B中的现象是________;若发现装置B中该现象不明显,可能的原因是________;查找原因时可用肥皂水或湿润的碘化钾淀粉试纸等,若用蘸有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有机物同分异构体数目判断中不正确的是
A. 立方烷( )的六氨基(-NH2)取代物有3种。
)的六氨基(-NH2)取代物有3种。
B. C3H7ClO(有羟基)的同分异构体数目有5种
C. 甲苯与氢气充分加成后的—溴代物有4种。
D. 分子式为C5H10O2的有机物中能与NaOH溶液反应的有13种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
(1)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,火焰呈__________色。
(2)实验室中需0.2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是__________。
A.1000mL;21.2g B.950mL;20.14g C.500mL;21.2g D.500mL;10.6g
(3)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为______。
(4)某同学为确定一包可能由碳酸钠和碳酸氢钠组成的白色混合物的成分,他取少量该白色物质溶于水,并向所得溶液中加入适量澄清石灰水,产生白色沉淀,据此该同学认为有碳酸钠。你是否同意该同学的观点,请你用适当的化学方程式阐述你的观点________。
(5)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
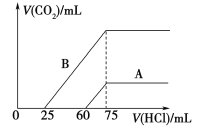
①曲线A表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为_______mL。
②曲线B表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________,其物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用太阳能分解制氢气,若光解0.02 mol水,下列说法正确的是( )
A.可生成H2的质量为0.02g
B.可生成氢的原子数为2.408×1023个
C.可生成H2的体积为0.224L(标准状况)
D.生成H2的量理论上等于0.02mol 锌与盐酸反应产生H2的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物。1,4-二氧杂螺[2.2]丙烷的结构简式为![]() 。下列说法正确的是
。下列说法正确的是
A. 1mol该有机物完全燃烧需要4molO2
B. 该有机物与 HCOOCH=CH2互为同分异构体
C. 该有机物的二氯代物有3种
D. 该有机物所有原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是用来衡量微观粒子多少的一种物理量
B.标况下O2的体积取决于O2分子间的距离
C.常温常压下4.8g O3含有的氧原子为0.3NA
D.若气体摩尔体积为22.4 L/mol,,则所处条件为标准状况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步需用过量的硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的离子组正确的是
A. 加入过量氨水:Fe3+、NH4+、SO42-、OH-
B. 加入过量NaClO溶液:Fe2+、Na+、ClO-、SO42-
C. 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH-
D. 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com