

请回答:
(1)H的化学式为_____________________。
(2)若A是一种常见酸性氧化物,且可用于制玻璃。写出A和碳反应制半导体材料的化学方程式:____________________________。
(3)若A是第三周期某金属元素的单质,当F的水溶液过量时,G为可溶性盐;当F的水溶液不足时,G为沉淀。写出E与少量F的水溶液反应的离子方程式:_________________。
(4)若A是一种常用化肥的主要成分,E与F反应有白烟产生。E分子的结构呈__________形。若在标准状况下,用体积为V L的烧瓶收集满F后做喷泉实验,假设溶液充满烧瓶且溶质不扩散,则该溶液中溶质的物质的量浓度为__________。(保留三位小数)
(1)NaCl
(2)SiO2+![]() Si+2CO↑
Si+2CO↑
(3)![]() +H++H2O
+H++H2O![]() Al(OH)3↓
Al(OH)3↓
(4)三角锥 0.045 mol·L-1
解析:本题突破口是抓住物质H的三个关键信息:一是生活中的常用物质;二是化工生产的重要原料;三是H溶液电解时能得到三种产物.综合以上信息可知H为NaCl.
(2)制造玻璃的原料为SiO2、Na2CO3和CaCO3.A可用于制玻璃,是常见酸性氧化物,则A为SiO2.由SiO2和C反应可以制取半导体材料Si.
(3)结合图表信息可知,F为HCl.A是第三周期金属单质,且A能与NaOH反应,可知A为Al.Al与NaOH反应生成NaAlO2.当盐酸过量时,G为AlCl3,盐酸不足时,G为Al(OH)3.
(4)E与HCl气体反应生成白烟,则E为NH3,其空间构型为三角锥形.
喷泉实验后溶液充满烧瓶,且溶质不扩散,烧瓶中所得溶液溶质的物质的量浓度为:(V L/


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

请回答:
(1)H的化学式为_________________。
(2)若A是一种常见酸性氧化物,且可用于制玻璃。写出A和碳反应制半导体材料的化学方程式:_______________________。
(3)若A是第三周期某金属元素的单质,当F的水溶液过量时,G为可溶性盐;当F的水溶液不足时,G为沉淀。写出E与少量F的水溶液反应的离子方程式:_________________。
(4)若A是一种常用化肥的主要成分,E与F反应有白烟产生。E分子的结构呈____________形。若在标准状况下,用体积为V L的烧瓶收集满F后做喷泉实验,假设溶液充满烧瓶且溶质不扩散,则该溶液中溶质的物质的量浓度为__________________。(保留三位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色
的固体化合物。(反应条件图中已省略。)
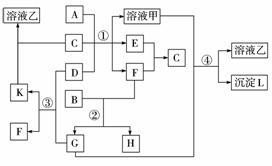
(1)A、B、C、D代表的物质分别为____________、____________、__________、____________(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是____________ ____________ ;
(3)反应②中,若B与F物质的量之比为4∶3,G、H分别是____________、____________(填化学式);
(4)反应③产物中K的化学式为____________;
(5)反应④的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中所有物质均由短周期元素组成,A的焰色反应为黄色,B、C、G均含同一种元素,D常温下为液体,B、C均溶于H的溶液。
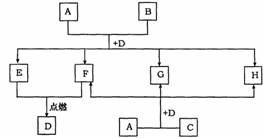
请回答:
(1)若B为金属,化学式为 ,工业上由C制取B的化学方程式为
;
(2)若B为非金属,化学式为 ,工业上由C制取B的化学方程式为
;
(3)若B为非金属,写出A+B+D→E+F+G+H的离子方程式(其中E和F的物质的量之比为3∶1): 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中各物质均由短周期元素组成,其中只有D、F、G为单质,A为淡黄色固体,B为常见的无色液体,一定条件下D、G和海水为原料可制成海洋电池。
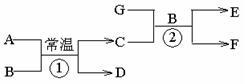
按要求填空:
(1)写出电子式A _________ B__________
(2)写出化学方程式①_ _ _______
②__ ________
(3)写出D、G和海水制成海洋电池的负极反应式_ ___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com