

分析 (1)利用三段式法计算平衡浓度,根据平衡常数表达式计算,温度不变,则平衡常数K不变;
(2)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
利用盖斯定律将$\frac{①+②}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),以此计算反应热,结合元素的化合价变化计算转移的电子数;
(3)从氧化还原反应的角度判断反应产物,进而写出相关反应的方程式.
解答 解:(1)①由图象知,体系总压强为0.10MPa时SO2的平衡转化率为0.8,则
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)
起始:2.0mol 1.0mol 0
转化:1.6mol 0.8mol 1.6mol
平衡:0.4mol 0.2mol 1.6mol
则平衡时:c(SO2)=0.04mol/L,c(O2)=0.02mol/L,c(SO3)=0.16mol/L,
K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2}).c({O}_{2})}$=$\frac{(0.16)^{2}}{(0.04)^{2}×0.02}$=800,
故答案为:800;
②平衡常数只受温度的影响,温度不变,则压强不变,平衡状态由A变到B时,则k(A)=k(B),
故答案为:=;
(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
利用盖斯定律将$\frac{①+②}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ/mol
n(CH4)=$\frac{4.48L}{22.4L/mol}$=0.2mol,
整个过程中转移的电子总数为:0.20mol×8NA=1.60NA,
放出的热量为:0.2mol×867kJ/mol=173.4kJ,
故答案为:1.60NA;173.4;
(3)由题意可知,铁酸盐(MFe2O4)经高温还原而得,则反应物中MFe2Ox为还原剂,SO2为氧化剂,生成物为MFe2O4和S,则反应的关系式为MFe2Ox+SO2→MFe2O4+S,
故答案为:MFe2Ox+SO2→MFe2O4+S.
点评 本题考查化学平衡及化学反应及能量,题目难度中等,本题易错点为化学平衡常数的计算,注意计算过程的把握,侧重于考查学生的分析能力和计算能力.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
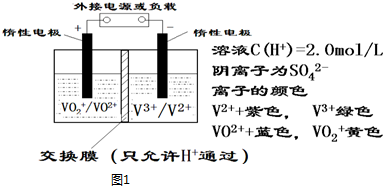
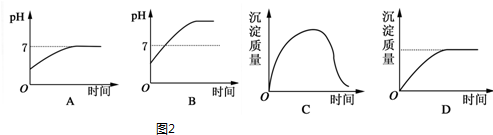
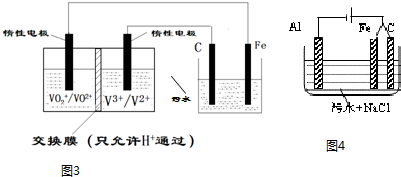
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
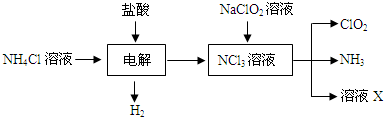
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| B. | 还原剂在反应中发生还原反应 | |
| C. | 氧化还原反应的本质是电子的转移 | |
| D. | 有单质生成的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油失火时,立即用水灭火 | |
| B. | 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤 | |
| C. | 浓 NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 | |
| D. | 实验室不小心碰翻酒精灯引起实验桌上洒落的少量酒精起火时,迅速用泡沫灭火器灭火 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com