
| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称量时,在天平托盘上放上称量纸,将NaOH固体放在纸上称量 | |
| C. | 在容量瓶中进行定容时俯视刻度线 | |
| D. | 定容后把容量瓶倒置摇匀,发现液面低于刻度线,又补足了所缺的水 |
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 0.5L的溶液中含有Na+、Mg2+、Al3+和SO42-四种离子,其中Na+、Mg2+和SO42-的浓度大小如图所示,则下列有关说法错误的是( )
0.5L的溶液中含有Na+、Mg2+、Al3+和SO42-四种离子,其中Na+、Mg2+和SO42-的浓度大小如图所示,则下列有关说法错误的是( )| A. | 该溶液中NaSO4的物质的量浓度为1.0mol•L-1 | |
| B. | 该溶液中MgSO4的物质的量为0.25mol | |
| C. | 该溶液中MgSO4的质量为30g | |
| D. | 该溶液中Al2(SO4)3的物质的量浓度为1.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
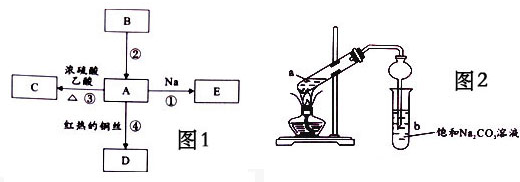
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2O2既是氧化剂又是还原剂 | |
| B. | K2FeO4的氧化性强于K2O2 | |
| C. | 16gFe2O3发生反应,有0.3mole-转移 | |
| D. | 用K2FeO4处理水时有Fe(OH)3胶体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1Mg(NO3)2溶液中含有0.2 NA个NO3- | |
| B. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| C. | 3mol Cu和足量稀硝酸反应产生2 NA个NO分子 | |
| D. | 1 mol Cl2与足量NaOH溶液反应,转移电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com