

分析 常见金属单质中能与NaOH溶液反应产生气体的只有Al,所以A是Al,乙是NaAlO2,C是H2;甲是Al的化合物,可和NaOH溶液反应产生NaAlO2,可甲能是Al2O3,则丙是H2O,B即是O2,根据NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓得丁是Al(OH)3,以此解答该题.
解答 解:(1)由以上分析可知A为Al,故答案为:Al;
(2)①2钠和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为Al+2OH-+2H2 O═2AlO2-+3H2↑,故答案为:Al+2OH-+2H2 O═2AlO2-+3H2↑;
②氧化铝为两性氧化物,与碱反应可生成偏铝酸钠和水,离子方程式为Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O;
③乙是NaAlO2,与二氧化碳反应生成氢氧化铝,方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(3)Al和氧化铁的反应为铝热反应,方程式为3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,故答案为:3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3;
(4)n(NaAlO2)=0.1mol,加入盐酸,如只发生AlO2-+H2O+H+=Al(OH)3↓,可消耗0.5molHCl,体积为100mL,
如先发生AlO2-+H2O+H+=Al(OH)3↓,再发生Al(OH)3+3H+=Al3++3H2O,消耗盐酸的物质的量为0.1mol+1.5mol=2.5mol,体积为500mL,
故答案为:100 或500.
点评 本题以“无机框图题”的形式考查元素单质及其化合物的性质,涉及化学式及离子方程式书写等,难度中等,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力,Al与碱的特殊的反应是推断的关键.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L - 1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L - 1KOH溶液,下列说法中正确的是( )| A. | 放电时K +移向负极 | |
| B. | 放电时电池负极的电极反应为H 2-2e -═2H + | |
| C. | 放电时电池正极的电极反应为NiO(OH)+H 2O+e -═Ni(OH) 2+OH - | |
| D. | 该电池充电时将碳电极与电源的正极相连,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 浓度均为0.1 mol/L的四种溶液中由水电离出的H+浓度由大到小的顺序是:氯化铵、醋酸、硫酸、氢氧化钠 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-和CrO42-,浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先沉淀 | |
| D. | 25℃时,取0.2mol•L-1 HClO溶液与0.2mol•L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(ClO-)=9.9×10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2O所含的水分子数为NA | |
| B. | 常温常压下,16 g氧气所占的体积为11.2 L | |
| C. | 同温同压下,1 mol任何物质所占的体积相等 | |
| D. | 标准状况下,2NA个二氧化碳分子所占的体积为44.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应可以被人类利用,而吸热反应无利用价值 | |
| B. | 当反应物总能量高于生成物总能量的时候,反应可能放热也可能吸热 | |
| C. | 非自发进行的反应一定不能发生 | |
| D. | 同种物质在气态时熵值最大,固体时最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
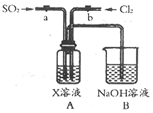 设计用图装置探究二氧化硫、氯气的化学性质通过控制弹簧夹a、b,向装置A中分别通入不同气体,请完成如下问题:
设计用图装置探究二氧化硫、氯气的化学性质通过控制弹簧夹a、b,向装置A中分别通入不同气体,请完成如下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com