
| 离子半径 | 得电子能力 | 酸性 | 金属性 |
| Cl->Al3+ | 16O=18O | H2CO3>H2SiO3 | Cu<Al |
 .
.分析 (1)N元素的原子序数为7,两个电子层,最外层只5个电子;
(2)电子层数越多,半径越大,所以半径大小为;Cl->Al3+,质子数相同,最外层电子数相同所以得电子能力相同,元素非金属性越强,最高价氧化物对应水化物的酸性越强,根据金属活动性顺序表判断;
(3)微粒2311Na+中的质子数是11,中子数是23-11=12,核外电子数是11;
(4)氯化镁为离子化合物,氯化镁中存在镁离子和氯离子,氯离子还需要标出最外层电子;
(5)质子数决定元素的种类,质子数和中子数决定原子的种类.
解答 解:(1)N元素的原子序数为7,两个电子层,最外层只5个电子,所以第二周期,第VA族,故答案为:2;VA;
(2)电子层数越多,半径越大,所以半径大小为;Cl->Al3+,质子数相同,最外层电子数相同所以得电子能力相同,即16O与得电子能力相同于18O,元素非金属性:C>Si,酸性:H2CO3>H2SiO3,根据金属活动性顺序表判断,金属性:Cu<Al,故答案为:>;=;>;<;
(3)微粒2311Na+中的质子数是11,中子数是23-11=12,核外电子数是11,故答案为:11;12;10;
(4)MgCl2,氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为: ,
,
故答案为: ;
;
(5)在${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、${\;}_{12}^{23}$Mg、${\;}_{12}^{24}$Mg和${\;}_{29}^{65}$Cu中有氢元素、镁和铜元素三种,这6种微粒均具有一定数目的质子数和一定数目的中子数,均属于原子,所以有六种原子,故答案为:3;6.
点评 本题考查学生教材中的基本概念和质量数、质子数、中子数之间的关系知识,可以根据所学知识进行回答,较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
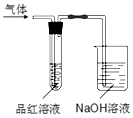 用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题:
用如图所示的实验装置,比较SO2和Cl2的漂白性.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
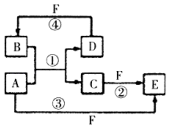 (1)短周期元素A、B、C、D、E的原子序数依次增大,A为半径最小的原子,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性,且A和E形成的化合物与A和B形成的化合物反应可产生白烟.回答下列问题:
(1)短周期元素A、B、C、D、E的原子序数依次增大,A为半径最小的原子,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性,且A和E形成的化合物与A和B形成的化合物反应可产生白烟.回答下列问题: ;
; ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成蓝色 | Cl2+2I-=I2+2Cl-(用离子方程式表示) |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=2HIO3+10HCl(用化学方程式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
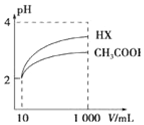 物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种.请根据所学化学知识回答下列问题:
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种.请根据所学化学知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
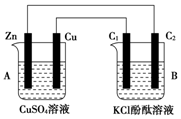 按图所示装置进行实验,并回答下列问题:
按图所示装置进行实验,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2只作氧化剂,O2是还原产物 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 由上述方程式可知氧化性:Na2FeO4>Na2O2>O2 | |
| D. | 2 mol FeSO4发生反应时,反应中共有8 mol电子转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com