
| A. | 碲的单质在常温下是固态 | B. | 碲的常见化合价是-2、+4、+6 | ||
| C. | 碲可能作半导体材料 | D. | 碲的氢化物H2Te很稳定 |
分析 碲位于钾的下一周期,与氧元素同一主族,所以Te位于第五周期第VIA族,属于氧族元素,根据氧族元素性质的相似性及递变性分析解答.
解答 解:碲位于钾的下一周期,与氧元素同一主族,所以Te位于第五周期第VIA族,属于氧族元素,
A.在氧族元素中,从S开始其单质为固体,所以常温下Te是固体,故A正确;
B.同主族元素含有相似的性质,S元素有-2、+4、+6化合价,故Te也有-2、+4、+6化合价,故B正确;
C.碲处于金属与非金属的交界处,可作半导体材料,故C正确;
D.同主族自上而下非金属性减弱,碲的氢化物H2Te很不稳定,故D错误;
故选D.
点评 本题考查同主族元素化合物性质的相似性与递变性,难度不大,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 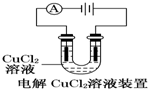 装置中阴极产生的气体能够使湿润淀粉KI试纸变蓝 | |
| B. | 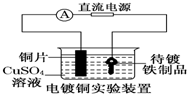 装置中待镀铁制品应与电源正极相连 | |
| C. |  装置中电子由b极流向a极 | |
| D. |  装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-、OH-、Cl-、NH4+ | B. | Na+、K+、HSO3-、Cl-. | ||
| C. | K+、Na+、S2-、NO3-. | D. | Na+、Al3+、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
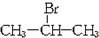 ,且烃A的结构简式为
,且烃A的结构简式为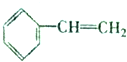 ,其在不同条件下能发生下图所示的一系列变化.
,其在不同条件下能发生下图所示的一系列变化.
 ,D
,D ,E
,E ,H
,H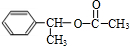 .
. +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr.
+NaBr. +2Br2→
+2Br2→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、硫酸 | B. | 氨水、氢氧化钠溶液 | ||
| C. | 氯化钠溶液、硫酸 | D. | 盐酸、氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com