
| A. | 氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| B. | NH4Al(SO4)2溶液与过量NaOH溶液反应:Al3++4OH-=AlO2-+2H2O | |
| C. | Na2SiO3溶液与稀盐酸混合:Na2SiO3+2H+=2Na++H2SiO3↓ | |
| D. | Ca(HCO3)2溶液和Ca(OH)2溶液混合:Ca2++HCO3-+OH-=CaCO3↓+H2O |
分析 A.发生氧化还原反应生成硝酸铁、NO和水;
B.漏写铵根离子与碱反应;
C.反应生成硅酸沉淀和氯化钠;
D.反应生成碳酸钙和水.
解答 解:A.氢氧化亚铁溶于稀硝酸的离子反应为NO3-+3Fe(OH)2+10H+=3Fe3++NO↑+8H2O,故A错误;
B.NH4Al(SO4)2溶液与过量NaOH溶液反应的离子反应为NH4++Al3++5OH-=AlO2-+2H2O+NH3.H2O,故B错误;
C.Na2SiO3溶液与稀盐酸混合的离子反应为SiO32-+2H+=H2SiO3↓,故C错误;
D.Ca(HCO3)2溶液和Ca(OH)2溶液混合的离子反应为Ca2++HCO3-+OH-=CaCO3↓+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法等为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 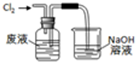 氧化废液中的溴化氢 | B. |  分离CCl4层和水层 | ||
| C. | 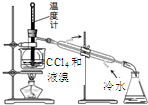 分离四氯化碳和液溴 | D. |  储存液溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PX 项目的主要产品对二甲苯属于饱和烃 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 保护加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
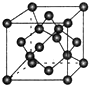 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
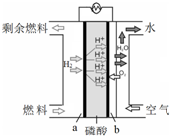
| A. | b极发生还原反应 | |
| B. | a极的反应式:H2+2OH--2e-═2H2O | |
| C. | 放电时,电子从b极经外电路流向a极 | |
| D. | 电池工作一段时间后,溶液中磷酸的浓度会升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com