
已知可逆反应aA+bB cC中,物质的含量R%(A%和C%)随温度的变化曲线如图所示,下列说法正确的是 ( )。
cC中,物质的含量R%(A%和C%)随温度的变化曲线如图所示,下列说法正确的是 ( )。
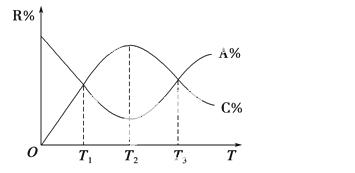
A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T2温度时达到过化学平衡
C.该反应的逆反应是放热反应
D .升高温度,平衡会向正反应方向移动
.升高温度,平衡会向正反应方向移动
科目:高中化学 来源: 题型:
医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:
(1)配平以下离子方程式,并在□中填上所需的微粒。
____H++____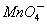 +_____H2C2O4→_____CO2↑+____Mn2++____□
+_____H2C2O4→_____CO2↑+____Mn2++____□
(2)该反应中的还原剂是_______________________。
(3)反应转移了0.4mol电 子,则消耗KMnO4的物质的量为_________mol。
子,则消耗KMnO4的物质的量为_________mol。
(4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是___________________。
②溶解沉淀时_____________(能或不能)用稀盐酸,原因是_____________。
③若消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则100mL该血液中含钙_______g
查看答案和解析>>
科目:高中化学 来源: 题型:
4种短周期元素相对位置如右表。M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。回答下列问题:
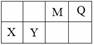
(1)X的原子结构示意图为 。
(2)0.1 molQ的10电子氢化物与CuO反应生成Cu2O、H2O和Q单质时,生成Cu2O的物质的量是 。
(3)Y的氧化物与NaOH溶液反应的化学方程式是 。
(4)HR是含M元素的一元酸。常温下,0.1 mol·L-1 HR 溶液中,c(H+) = 1.3×10-3 mol·L-1。则HR  H++R-的电离平衡常数Ka= (保留一位小数)。
H++R-的电离平衡常数Ka= (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:
v(H2O2)≈3.3×10-2mol·L-1·min-1
B.0~6 min的平均反应速率:
v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6 min时,c(H2O2)=0.30 mol/L
D.反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
在可逆反应2SO2+O2 2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商) ( )。
2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商) ( )。
A.Qc不变,K变大,O2转化率增大
B.Qc不变,K变大,SO2转化率增大
C.Qc变小,K不变,O2转化率减小
D.Qc增大,K不变,SO2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
298 K时,某容积固定为1 L的密闭容器中发生如下可逆反应:A(g)2B(g) ΔH=a  kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
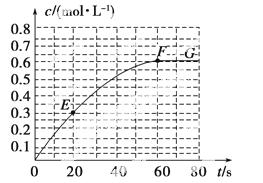
试回答下列问题:
(1)已知298 K时60 s达到平衡,则前60 s内A的平均反应速率为________mol·L-1·s-1。
(2)该反应的平衡常数表达式为________。
(3)若298 K时B的平衡浓度为A的3倍,323 K时( 其他条件不变),B的平衡浓度为A的2倍。且达到平衡所需时间为298 K时的
其他条件不变),B的平衡浓度为A的2倍。且达到平衡所需时间为298 K时的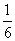 。该反应中ΔH________0(填“>”或“<”)。
。该反应中ΔH________0(填“>”或“<”)。
(4)若反应在298 K进行,在1 L密闭容器中加入1 mol B、0.2 mol Ne,达到平衡时B的转化率为________(填序号)。
A.等于60% B.等于40%
C.小于40% D.介于40%~60%之间
(5)已知曲线上任意两点之间连线的斜率表示该时间段内B的平均反应速率(例如直线EF的斜率表示20 s~60 s内B的平均反应速率),则曲线上任意一点的切线斜率的意义是______________________________________________ __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式硫酸铁Fe(OH)SO4对水中的悬浮物、有机物、硫化物、重金属等都能絮凝,工业上常用硫酸亚铁法制备,工艺流程如下图所示:
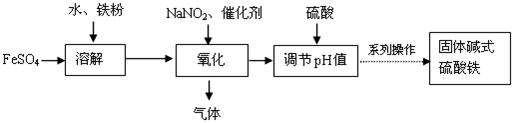
已知: Fe3+沉淀完全时的pH=3.1, Fe2+沉淀完全时的pH=9.7。
(1)请写出溶解过程中加快溶解速率和提高浸出率的两点措施:
_______________________________,______________________________。
(2)加入硫酸的作用是控制体系的pH值,若硫酸加入量过小,反应体系酸度太低,容易生成 沉淀;若硫酸加入量过大,不利于产品形成,试从平衡移动的角度分析原因是 。
(3)氧化过程中生成的气体遇空气变红棕色。写出氧化过程发生的离子方程式:
________________________________________________________________。
(4)流程图中的“系列操作”包括 , ,过滤,洗涤,烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g)  B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为____________。
(2)由总 压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________。
压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反 应物A的物质的量n(A),n(总)=________ mol,n(A)=________ mol。
应物A的物质的量n(A),n(总)=________ mol,n(A)=________ mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
| 反应时间t/h |
| 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔( Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________
Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________
mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
将250mLH2SO4的质量分数为98%,密度为1.84g/cm3的浓硫酸稀释到1000mL。
(1)稀释前溶液中H2SO4的物质的量浓度是多少?
(2)稀释后溶液中H+的物质的量浓度是多少?
(3 )若要制取3.36LH2 (标准状况),则要用量筒量取稀释后的硫酸溶液多少毫升?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com