
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| C. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| D. | 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |
分析 A.如果该溶液既含Fe3+,又含Fe2+,滴加KSCN溶液,溶液呈红色,证明存在Fe3+,并不能证明无Fe2+;
B.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,不能证明无K+,因为黄光可遮住紫光,K+焰色反应需透过蓝色的钴玻璃滤去黄光后观察;
C.无水硫酸铜吸水变为CuSO4•5H2O,白色粉末变蓝,可证明原气体中含有水蒸气;
D.能使澄清石灰水变浑浊的气体有CO2、SO2等.
解答 解:A.Fe3+遇KSCN会使溶液呈现红色,Fe2+遇KSCN不反应无现象,如果该溶液既含Fe3+,又含Fe2+,滴加KSCN 溶液,溶液呈红色,则证明存在Fe3+,并不能证明无Fe2+,故A错误;
B.灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,并不能证明无K+,Na+焰色反应为黄色,可遮住紫光,K+焰色反应需透过蓝色的钴玻璃滤去黄光后观察,故B错误;
C.气体通过无水硫酸铜,粉末变蓝,则发生反应:CuSO4+5H2O═CuSO4•5H2O,可证明原气体中含有水蒸气,故C正确;
D.能使澄清石灰水变浑浊的气体有CO2、SO2等,故将气体通入澄清石灰水,溶液变浑浊,则原气体不一定是CO2,故D错误;
故选C.
点评 本题考查常见离子的检验方法,题目难度中等,侧重对基础知识的考查,明确常见离子的性质及检验方法为解答关键,注意对基础知识的掌握积累.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:填空题
化合物A[KxFe(C2O4)y·zH2O,其中铁元素为+3价]是一种重要的光化学试剂。
(1)制备化合物A的实验流程如下:
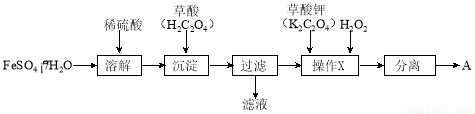
① 上述流程中,检验“过滤”后的固体已洗涤干净的方法是 。
② 上述流程“操作X”中加入H2O2的目的是  。
。
(2)测定化合物A的化学式实验步骤如下:
a、准确称取A样品4.91g,干燥脱水至恒重,残留物质的质量为4.37g;
b、将步骤a所得固体溶于水,加入还原铁粉0.28g,恰好完全反应;
c、另取A样品4.91g置于锥形瓶中,加入足量的3 mol/L的H2SO4溶液和适量蒸馏水,再加入0.50mol/L的KMnO4溶液24.0 mL,微热,恰好完全反应:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
通过计算填空,请写出解题过程。
① 4.91g A样品中含结晶水的物质的量为 mol。
② A样品中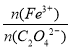 = 。
= 。
③ A的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列化学用语表达正确的是
A.硫原子的结构示意图: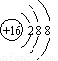
B.氯化氢分子的电子式: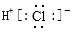
C.乙烯的结构简式:CH2CH2
D.碳酸氢钠溶于水的电离方程式:NaHCO3=Na++HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
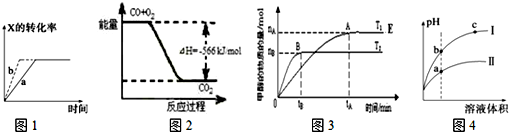
| A. | 图1所示,反应:X(g)+2Y(g)?3Z(g),b的压强一定比a大 | |
| B. | 图2表示CO生成CO2的反应过程和能量关系 | |
| C. | 图3表示反应CO+2H2?CH3OH(g),其中温度T2>T1,在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的$\frac{1}{2}$,平衡正向移动,氢气浓度增大 | |
| D. | 图4所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活动性比铁的弱,铜不能与任何强酸发生反应 | |
| B. | 浓硫酸可用作干燥剂是因为其具有强氧化性 | |
| C. | 利用Al2O3制作的坩埚,可用于熔融烧碱 | |
| D. | 制水泥和玻璃都用石灰石作原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
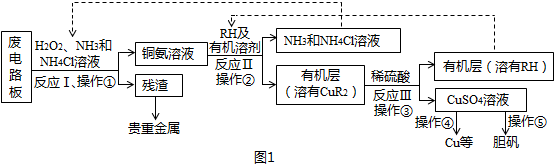
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com