
下列说法不正确的是
A. 将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸
B. 0.1mol 的NaHCO3溶液中
的NaHCO3溶液中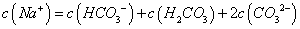
C. 0.1mol 的NaHA溶液PH=5,则溶液:
的NaHA溶液PH=5,则溶液: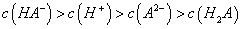
D. pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液pH>7
科目:高中化学 来源: 题型:
(1)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重,为了将石蜡和碳酸钙溶出,应选用的试剂是__________。
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d.正己烷
(2)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出_____________________,目的是:__________________________________________________________。
Ⅱ.实验室制备氯气的装置如下图。

(1)装置①中发生离子反应方程式:_______________________________________;
(2)①用含HCl 146 g的浓盐酸与足量的MnO2反应;②用87 g MnO2与足量浓盐酸反应。所得的氯气:①__________② (填写<、>、=);
(3)上述装置不合理的是:______________(填写装置序号)。
Ⅲ.某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

(1)装置A中发生反应的化学方程式为______________________________________;
(2)装置B中反应的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )

A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种①在该溶液中加入足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色的溶液中加入BaC12溶液时无沉淀生成;③向淀粉溶液中滴加该橙黄色溶液未变蓝色,则在该溶液中肯定存在的离子组是
A.Na+、SO32-、I- B.Na+、Br-、CO32-
C.Fe2+、I-、SO32- D.Fe2+、CO32-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验表述正确的是

A.图l:用于制取纯净的NO2气体 B.图2:用于研究温度对化学平衡的影响
C.图3:用于实验室Cl2的收集 D.图4:用于除去CO2气体中的HCl杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
碳和氮的许多化合物在工农业生产和生活中有重要的作用。
28、工业上生产硝酸所需要的一氧化氮常用氨气来制备,该反应的化学方程式为
29、以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)→NH2CO2 NH4(s) +l59.5 kJ·mol-1
②NH2CO2NH4(s) →CO(NH2)2(s)+H2O(g) -116.5 kJ·mol-1
③H2O(1) →H2O(g) -44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
30、以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。每消耗3.4g NH3转移的电子数为 (阿伏加德罗常数的值用NA表示)。
31、用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ====N2(g)+CO2(g)+Q kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(Min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通人一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q 0(填 “>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Si有良好的半导体性能 | Si可用于制备光导纤维 |
| B | 铁比铜活泼 | 铜板上的铁钉在潮湿空气中容易生锈 |
| C | 蛋白质和淀粉都是高分子化合物 | 蛋白质和淀粉水解最终产物均是葡萄糖 |
| D | 汽油和植物油都属于烃 | 汽油和植物油都可以燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下, 2.8g N2与C2H4的混合气体所含电子数为1.4 NA
B.标准状况下,1.12 L NO与1.12LO2的混合物中含有的原子数为0.2NA
C.25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA
D.常温下,1 L 0.1 mol·L-1的NH4NO3溶液中氧原子数为0.3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com