
科目:高中化学 来源:2011年高考化学总复习30分钟限时训练:专题8 溶液中的离子平衡 题型:022
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”).
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”).
(2)已知:O2(g) O
O![]() (g)+e- ΔH1=1175.7 kJ·mol-1
(g)+e- ΔH1=1175.7 kJ·mol-1
PtF6(g)+e- PtF(g) ΔH2=-771.1 kJ·mol-1
PtF(g) ΔH2=-771.1 kJ·mol-1
O
 O
O则反应
O2(g)+PtF6(g) O
O(3)
在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________.已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20.(4)
在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
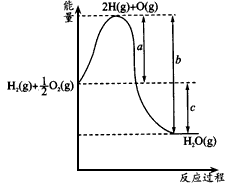
①H2(g)![]() 2H(g) ΔΗ1=+431.8 kJ·mol-1
2H(g) ΔΗ1=+431.8 kJ·mol-1
②![]() O2(g)
O2(g)![]() O(g) ΔΗ2=+244.3 kJ·mol-1
O(g) ΔΗ2=+244.3 kJ·mol-1
③2H(g)+O(g)![]() H2O(g) ΔΗ3=-917.9 kJ·mol-1
H2O(g) ΔΗ3=-917.9 kJ·mol-1
④H2O(g)![]() H2O(l) ΔΗ4=-44.0 kJ·mol-1
H2O(l) ΔΗ4=-44.0 kJ·mol-1
写出1 mol H2(g)与适量O2(g)生成H2O(l)反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应 N2(g)+3H2(g)![]() 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_________移动(填“向左”“向右”或“不”);使用催化剂_________反应的
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_________移动(填“向左”“向右”或“不”);使用催化剂_________反应的
△H(填“增大”“减小”或“不变”)。
(2)已知:O2 (g)= O+2(g)+e- ![]() H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1
![]() PtF6(g)+ e- =PtF6-(g)
PtF6(g)+ e- =PtF6-(g) ![]() H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
![]() O2+PtF6-(s)=O2+(g)+PtF6-
O2+PtF6-(s)=O2+(g)+PtF6- ![]() H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
![]() 则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的![]() H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源:2010-2011年福建省福州八中高二下学期期末考试化学试卷 题型:填空题
(16分) (1)已知:
(1)已知:
O2 (g) = O+2(g) + e-  H1=" 1175.7" kJ·mol-1
H1=" 1175.7" kJ·mol-1 PtF6(g) + e- = PtF6-(g)
PtF6(g) + e- = PtF6-(g)
 H2=" -" 771.1 kJ·mol-1
H2=" -" 771.1 kJ·mol-1 O2+ PtF6-(s) = O2+(g) + PtF6-
O2+ PtF6-(s) = O2+(g) + PtF6- 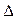 H3="482.2" kJ·mol-1
H3="482.2" kJ·mol-1  则反应O
则反应O 2(g)+ PtF6 (g) = O2+PtF6- (s)
2(g)+ PtF6 (g) = O2+PtF6- (s) 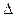 H="_____________" kJ·mol-1
H="_____________" kJ·mol-1
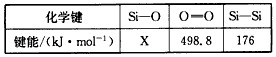
(2)由C和S形成的液态化合物CS2,0.2mol/l CS2在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215k J。该反应的热化学方程式为________。
J。该反应的热化学方程式为________。
(3)已知:常温下0.1mol/L的某酸H2A的pH=4,则该酸为 酸(填“强”或“弱”),H2A的电离方程式为 ,该溶液中由水电离出的c(H+)= 。
(4)一定温度下,两种酸:a、盐酸 b、醋酸:
①当两种酸的物质的量浓度相同时,c(H+):a b(填“>”、“<”或“=”,下同)。
②在pH相同、体积相同的两种酸溶液中加入过量的铁粉,反应结束时生成H2的总体积:a b。
③将pH相同,体积相同的两种酸溶液分别加水稀释100倍,所得溶液的pH值:a b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com