
【题目】以CuSO4溶液和不同酸根离子形成的钠盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。

(1)经检验,现象I的白色沉淀为CuI,则反应的离子方程式为_____________________,氧化产物与还原产物的物质的量之比为____________。
(2)经检验,现象Ⅱ中产生的气体是二氧化碳,绿色沉淀是碱式碳酸铜[xCuCO3·yCu(OH)2·zH2O]。现采用氢气还原法测定碱式碳酸铜组成,请回答如下问题:
①写出xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式__________________________________________________;
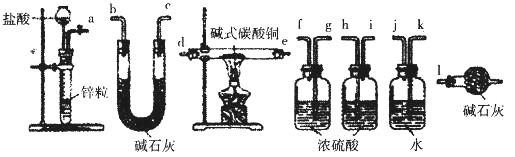
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填仪器接口字母编号):a→_______→g f→____→_____→_____→l
(3)经检验,现象Ⅲ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。
已知:Cu+![]() Cu+Cu2+
Cu+Cu2+
①用稀硫酸证实沉淀中含有Cu+的实验现象是______________________________。
②通过下列实验证实,沉淀中含有Cu2+和SO32-
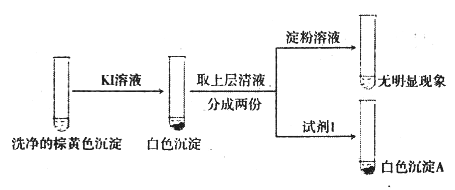
a.白色沉淀A是BaSO4,试剂1是_____________________。
b.证实沉淀中含有Cu+和SO32-的理由是___________________________。
【答案】2 Cu2++4I-= 2CuI↓+ I2 1:2 xCuCO3·yCu(OH)2·zH2O+(x+y)H2![]() (x+y) Cu+ xCO2+(x+2y+z) H2O kj de hi bc 有红色固体析出 盐酸和BaCl2溶液 在I-作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-
(x+y) Cu+ xCO2+(x+2y+z) H2O kj de hi bc 有红色固体析出 盐酸和BaCl2溶液 在I-作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-
【解析】
(1)经检验,现象I的白色沉淀为CuI,铜元素的化合价由+2价降低到-1价,则碘离子中碘元素化合价由-1价升高到0价,则反应的离子方程式为2 Cu2++4I-= 2CuI↓+ I2;该反应中氧化产物为碘单质,还原产物为CuI,所以氧化产物与还原产物的物质的量之比为1:2;综上所述,本题答案是:2 Cu2++4I-= 2CuI↓+ I2;1:2。
(2) ①xCuCO3·yCu(OH)2·zH2O与氢气反应生成单质铜、水、二氧化碳,反应方程式为:xCuCO3·yCu(OH)2·zH2O+(x+y)H2![]() (x+y) Cu+ xCO2+(x+2y+z) H2O;综上所述,本题答案是:xCuCO3·yCu(OH)2·zH2O+(x+y)H2
(x+y) Cu+ xCO2+(x+2y+z) H2O;综上所述,本题答案是:xCuCO3·yCu(OH)2·zH2O+(x+y)H2![]() (x+y) Cu+ xCO2+(x+2y+z) H2O。
(x+y) Cu+ xCO2+(x+2y+z) H2O。
②实验中要测定生成的水、二氧化碳的量,从a口出来气体中含有水蒸气和挥发出来的氯化氢气体,会对实验造成干扰,应先用水吸收氯化氢气体,再用浓硫酸吸收水蒸气;之后,与碱式碳酸铜发生反应,产生的两种气体先用浓硫酸吸收水蒸气,再用U型管中的碱石灰吸收二氧化碳,同时连上装有碱石灰的球形干燥管,避免空气中的水和二氧化碳进入U型管而产生误差,因此装置的连接顺序为:a→kj→gf→de→hi→bc→l;综上所述,本题答案是:kj ,de, hi, bc。
(3)①由已知可知Cu+和稀硫酸反应生成Cu和Cu2+,所以用稀硫酸证实沉淀中含有Cu+的实验操作和现象为取一定量的沉淀于试管中,向其中加入稀硫酸,有红色固体析出。综上所述,本题答案是:有红色固体析出。
②a.证明溶液中有SO42-,需要加入盐酸和BaCl2溶液,生成白色沉淀BaSO4,因此试剂1是HCl和BaCl2溶液;综上所述,本题答案是:盐酸和BaCl2溶液。
b.根据“已知”,加入KI溶液生成白色沉淀CuI,说明溶液中有Cu2+,向清液中加入淀粉溶液没有颜色变化,说明生成的I2被SO32-还原成I-,SO32-被氧化为SO42-,向清液中加入盐酸和BaCl2溶液,产生BaSO4沉淀;因此证实沉淀中含有Cu2+和SO32-的理由是在I-作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-,溶液中存在Cu2+和SO32-;综上所述,本题答案是:在I-作用下,Cu2+转化为白色沉淀CuI,SO32-转化为SO42-。


科目:高中化学 来源: 题型:
【题目】已知NH3、HCl极易溶于水,Cl2能溶于水。下列各装置不能达到实验目的是
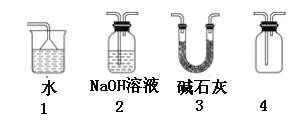
A. 利用1吸收多余的氨气
B. 装置2可用于除去CO2中的HCl
C. 装置3可用于干燥氨气
D. 装置4可用于排空气法收集H2、CO2、Cl2、HCl等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率的关系是2v逆(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,其中NH3被氧化为常见的无毒物质。下列说法错误的是( )
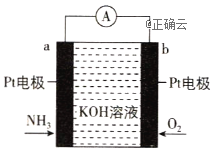
A. 溶液中OH-向电极a移动
B. 电极b上发生还原反应
C. 负极的电极反应为2NH3-6e-+6OH-![]() N2+6H2O
N2+6H2O
D. 理论反应消耗的NH3与O2的物质的量之比为3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 有机物只能从有机体中取得
B. 有机物和无机物的组成、结构、性质有严格区别,它们不能相互转化
C. 人类只是从现代才使用有机物
D. 合成树脂、合成橡胶、合成纤维等均属于有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了建设环境友好型社会,节能减排将成为我国政府目前工作的重点,因此节约能源与建设新能源是摆在当前的一个课题。针对这一现象,某化学学习研究性小组提出如下方案,你认为不够科学合理的是
A.采用电解水法制取氢气作为新能源B.完善煤液化制取汽油的技术
C.研制推广以乙醇为燃料的汽车D.进一步提高石油加工工艺
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中Fe3+和I-存在可逆反应:2Fe3++2I-![]() 2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
A. 反应的平衡常数K=![]()
B. 该可逆反应只能在酸性条件下存在
C. 加入AgNO3,平衡右移,溶液黄色变浅
D. 加入CCl4,平衡右移,水溶液层黄色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com