
| A. | 某无色透明溶液中:Fe2+、Al3+、NO3-、Cl-、S2- | |
| B. | 加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、Cl- | |
| C. | 0.1 mol•L-1的NaHCO3溶液中:K+、Na+、SO42-、CO32- | |
| D. | 加入Mg能放出H2的溶液中:Mg2+、NH4+、ClO-、K+、SO42- |
分析 A.亚铁离子为有色离子,亚铁离子、铝离子都与硫离子反应;
B.该溶液中存在大量氢离子或氢氧根离子,铵根离子与企业广告离子反应,酸性条件下硝酸根离子与铝反应不会生成氢气;
C.四种离子之间不反应,都不与碳酸氢钠反应;
D.该溶液呈酸性,次氯酸根离子与氢离子、镁离子反应.
解答 解:A.Fe2+为有色离子,Fe2+、Al3+都与S2-之间发生反应,在溶液中不能大量共存,故A错误;
B.加入铝粉后产生大量氢气的溶液中存在大量氢离子或氢氧根离子,NH4+与氢氧根离子反应,酸性条件下NO3-与反应不会生成氢气,故B错误;
C.K+、Na+、SO42-、CO32-之间不发生反应,都不与NaHCO3反应,在溶液中能够大量共存,故C正确;
D.加入Mg能放出H2的溶液中存在大量氢离子,Mg2+与H+、ClO-发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:解答题
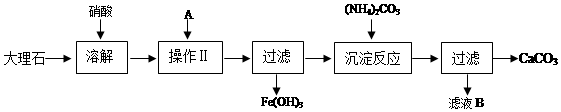
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和 Cl2反应 | B. | 乙烯和 Cl2反应 | ||
| C. | 乙烯和 HCl 反应 | D. | 乙烯和 H2、Cl2 反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol | B. | 2mol | C. | 2.5mol | D. | 3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ | Fe2+ | Ca2+ | Ba2+ |
| 阴离子 | NO3- | CO3-2 | SiO32- | SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色胶状沉淀并放出标准状况下0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的小 | |
| B. | AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L | |
| C. | 将0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl,无沉淀析出 | |
| D. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
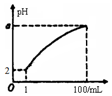 pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )
pH=2的弱酸HA溶液1mL,加水稀释到100mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是( )| A. | a的取值范围为2<a<4 | |
| B. | HA溶液加热时,溶液酸性增强 | |
| C. | 与pH=12的NaOH溶液等体积混合后溶液的pH=7 | |
| D. | HA溶液与NaOH溶液恰好完全反应时,c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com