
【题目】有机合成在化工医药领域应用广泛,下图是一种新型药物合成路线。
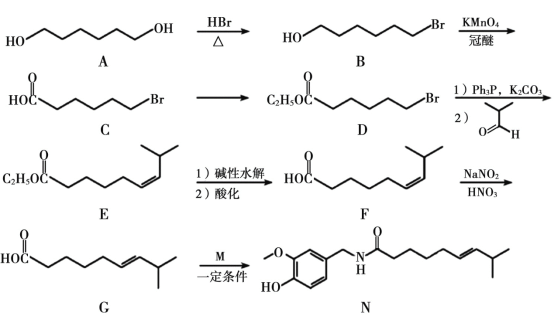
回答下列问题:
(1)A 的系统命名法(CCS)名称为________,D 中官能团的名称为________。
(2)B→C 的反应类型为________,从反应所得液态有机混合物中提纯 B 的常用方法为________。
(3)C→D 的化学方程式为________。C 和 D 在下列哪种检测仪上显示出的信号峰是完全相同的_________
A.元素分析仪 b.红外光谱仪 c.核磁共振仪 d.质谱仪
(4)C 的同分异构体 W(不考虑手性异构)可发生银镜反应,且 1 mol W 最多与 2 molNaOH 发生反应,产物之一可被氧化成二元醛,满足上述条件的 W 有________种。若 W 的核磁共振氢谱具有四组峰,则其结构简式为________。
(5)F 与 G 的关系为(填序号)________。
A.碳链异构 b.官能团类别异构 c.顺反异构 d.官能团位置异构
(6)M 的结构简式为________。
(7)参照上述合成路线,以![]() 和
和![]() 为原料制备医药中间体
为原料制备医药中间体![]() ,写出合成路线流程图_________________________________________________________________。
,写出合成路线流程图_________________________________________________________________。
【答案】1,6-己二醇 溴原子、酯基 氧化反应 减压蒸馏(或蒸馏)  +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O a 5
+H2O a 5 ![]() c
c 
 或
或
【解析】
A中的一个羟基和HBr发生取代生成B,B被高锰酸钾氧化为C,C和乙醇发生酯化反应生成D,D经两步反应生成E,E发生碱性水解,然后酸化,生成F,F为顺式结构,在NaNO2和HNO3作用下变为反式结构G,G和M反应生成N,对比G和N的结构可看出,M为 。
。
(1)A为![]() ,是二元醇,系统命名法名称为1,6-己二醇,D 为
,是二元醇,系统命名法名称为1,6-己二醇,D 为 ,官能团为溴原子和酯基。
,官能团为溴原子和酯基。
(2)由以上分析可知,B→C 的反应类型为氧化反应,从反应所得液态有机混合物中提纯 B 的常用方法为减压蒸馏(或蒸馏)。
(3)C→D是酯化反应,化学方程式为 +CH3CH2OH
+CH3CH2OH![]()
![]() +H2O。C 和 D 的组成元素相同,所以在元素分析仪上有相同的信号峰,但C和D的官能团不完全相同、不同化学环境的氢原子的个数不同、相对分子质量不同,所以在红外光谱仪、核磁共振仪和质谱仪的信号峰都不完全相同,故选a。
+H2O。C 和 D 的组成元素相同,所以在元素分析仪上有相同的信号峰,但C和D的官能团不完全相同、不同化学环境的氢原子的个数不同、相对分子质量不同,所以在红外光谱仪、核磁共振仪和质谱仪的信号峰都不完全相同,故选a。
(4)C的分子式为C6H12O2Br,不饱和度为1;它的同分异构体 W可发生银镜反应,说明分子中有醛基; 1 mol W 最多与 2 molNaOH 发生反应,说明分子中有1个酯基,酯基和溴原子都会消耗NaOH;水解产物之一可被氧化成二元醛,说明水解后得到二元醇,且两个羟基都连在链端。则满足上述条件的 W 为HCOOCH2CH2CH2CH2CH2Br、HCOOCH2CH(CH2Br)CH2CH3、HCOOCH2CH(CH3)CH2CH2Br、HCOOCH2CH2CH(CH3)CH2Br、 ,共5种。若 W 的核磁共振氢谱具有四组峰,则为
,共5种。若 W 的核磁共振氢谱具有四组峰,则为 。
。
(5)由以上分析可知,F 与 G 的关系为顺反异构,故选c。
(6) 由以上分析可知,M 的结构简式为 。
。
(7) 以![]() 和
和![]() 为原料制备
为原料制备![]() , 可以参照题干中D→E的反应,需要先制备卤代烃和含碳氧双键的物质,所以可以是把1-丙醇氧化为丙醛,把2-丙醇转化为2-溴丙烷:
, 可以参照题干中D→E的反应,需要先制备卤代烃和含碳氧双键的物质,所以可以是把1-丙醇氧化为丙醛,把2-丙醇转化为2-溴丙烷: ;也可以是把2-丙醇氧化为丙酮,把1-丙醇转化为1-溴丙烷:
;也可以是把2-丙醇氧化为丙酮,把1-丙醇转化为1-溴丙烷: 。
。


科目:高中化学 来源: 题型:
【题目】化学与生命活动密切相关。以下是人体中血红蛋白、肌红蛋白与O2结合机制的相关研究,假定其环境温度均为36.8℃。
(1)血红蛋白Hb结合O2形成动脉血,存在反应①:HbH+(aq)+O2(g)![]() HbO2(aq)+H+(aq)。该反应可自发进行,则其ΔH______0(填“>”或“<”);血液中还同时存在反应②:CO2+H2O
HbO2(aq)+H+(aq)。该反应可自发进行,则其ΔH______0(填“>”或“<”);血液中还同时存在反应②:CO2+H2O![]() H++HCO3-,结合反应①②,肺部氧分压_____(填“较高”或“较低”)有利于CO2排出体外,从化学平衡角度解释原因 ____________。
H++HCO3-,结合反应①②,肺部氧分压_____(填“较高”或“较低”)有利于CO2排出体外,从化学平衡角度解释原因 ____________。
(2)肌肉中大量肌红蛋白 Mb也可结合O2形成MbO2,即反应③:Mb(aq)+O2(g)![]() MbO2(aq),其平衡常数K=
MbO2(aq),其平衡常数K=![]() 。其它条件不变,随着氧分压p(O2)增大,K值___(填“变大”、“变小”或“不变”)。已知在氧分压p(O2)=2.00 kPa 的平衡体系中,
。其它条件不变,随着氧分压p(O2)增大,K值___(填“变大”、“变小”或“不变”)。已知在氧分压p(O2)=2.00 kPa 的平衡体系中, =4.0。吸入的空气中p(O2)=21 kPa,计算此时 Mb与氧气的最大结合度(平衡转化率)约为_______________(保留两位有效数字)。
=4.0。吸入的空气中p(O2)=21 kPa,计算此时 Mb与氧气的最大结合度(平衡转化率)约为_______________(保留两位有效数字)。
(3)Hb分子具有四个亚基,且每个亚基有两种构型(T型和R型)。图中,T0、R0表示未结合O2的T型和R型,且存在可逆的变构效应:T0![]() R0,正向平衡常数为K0;当四分子O2与Hb的四个亚基结合后,T4
R0,正向平衡常数为K0;当四分子O2与Hb的四个亚基结合后,T4![]() R4也是变构效应,正向平衡常数为K4。
R4也是变构效应,正向平衡常数为K4。

①已知某肺炎病人肺脏中T0+4O2![]() T4反应的n(O2)数据如下:
T4反应的n(O2)数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(O2)/10-6 mol | 1.68 | 1.64 | 1.58 | 1.50 | 1.40 |
计算2.0 min~8.0 min内以T的物质的量变化表示的反应速率v(T4)为_________mol·min-1。
②现假定R型Hb对O2的结合常数为KR,T型Hb对O2的结合常数为KT。已知KR>KT,则图中K0____K4(填“>”或“<”)。
(4)氧气是生命活动必不可少的物质。如下图所示,以Pt为阳极,Pb(CO2)的载体,使CO2活化为阴极,电解经CO2饱和处理的KHCO3溶液可使氧气再生,同时得到甲醇。其阴极反应式为____;从电解后溶液中分离甲醇的操作方法是_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与环境、科学、技术密切相关。下列有关说法中正确的是( )
A.华为首款5G手机搭载了智能的7nm制程SoC麒麟980芯片,此芯片主要成分是二氧化硅
B.用于制作N95型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯的分子长链上无支链
C.国产飞机C919用到的氮化硅陶瓷是传统有机非金属材料
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业含铜废料含有 Cu、CuO、CuS、CuSO4 等成分,利用该含铜废料可生产硝酸铜晶体[Cu(NO3)2·3H2O],生产的工艺流程如图所示,请回答下列问题:

(1)“焙烧”过程中生成的废气中有害气体的成分是______________。
(2)“酸化”过程为加快反应速率,可采用的措施有___________________________(写出一条即可)。
(3)若试剂 a 可以是____________,试剂b的作用是______________________________________。
(4)“反应”一步中使用 20% HNO3 和 10% H2O2,整个过程无红棕色气体产生,则发生反应的离子方程式为______________________________________;若该步骤只使用 20% HNO3,随着反应的进行,温度升高,出现大量红棕色气体,则还原剂与氧化剂的物质的量之比为_______________。
(5)“系列操作”中应包含____________、______________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种新型离子化合物,该物质由两种阳离子和两种阴离子构成,其中有一种 18 电子离子和两种 10 电子离子。W、X、Y、Z 均为短周期元素,且均不在同一主族。下列说法不正确的是
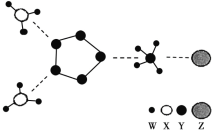
A.X 与 W 形成的化合物沸点高于 X 同族元素与 W 形成的化合物
B.Z 的最高价氧化物对应水化物的酸性比 Y 的强
C.Y 气态氢化物的稳定性比 X 的强
D.如图化合物中,存在极性共价键和非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染物主要成分是SO2、NO2、NO、CO及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气,会导致雾霾、酸雨等。
(1)汽车的三元催化转化器中,在催化剂作用下NO和CO转化为无毒气体,反应的化学方程式是: 2CO+2NO ![]() 2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
2CO2+N2,该反应中,氧化剂是____________(填化学式),氧化产物是______________(填化学式),当生成2mol N2时,转移电子的物质的量是____________________。
(2)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2转化为SO42―。已知0.1mol/L 100mLNaClO溶液,可以恰好吸收0.01moL SO2,则反应的离子方程式是______________________。
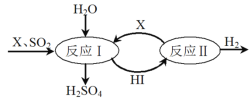
(3)SO2通过如图过程既能制得H2SO4又能制得H2。图中可循环利用的物质X是_________(填化学式),制得H2SO4的化学方程式是__________________________。
(4)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO2+NO+2NaOH===2NaNO2+H2O 2NO2+2NaOH===NaNO2+NaNO3+H2O
现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。所用烧碱溶液的物质的量浓度至少为________ mol·L1。若所得溶液中c(![]() )∶c(
)∶c(![]() )=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
B.![]() =1×10﹣15mol/L的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
=1×10﹣15mol/L的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3﹣、SO42﹣
D.水电离的c(H+)=1×10﹣15mol/L的溶液中:K+、Na+、AlO2﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.6 g镁铝合金,投入到500 mL 2 mol/L的盐酸中,合金完全溶解,再加入4 mol/L的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是( )
A.150 mLB.200 mLC.250 mLD.280 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.工业上合成氨要用高温,催化剂
C.红棕色的NO2加压后颜色先变深再变浅
D.CO2(g)![]() CO2(aq)ΔH<0,降温增压可增大二氧化碳气体在水中的溶解度
CO2(aq)ΔH<0,降温增压可增大二氧化碳气体在水中的溶解度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com