
【题目】Cr、S等元素的化合物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)还原沉淀法是处理含铬(Cr2O72和CrO42)工业废水的常用方法,过程如下:
![]()
①已知:常温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。则上述流程中CrO42-转化为Cr2O72-的离子方程式为______________________。

②还原过程中氧化剂与还原剂的物质的量之比为__________。
③Cr3+与Al3+的化学性质相似,对CrCl3溶液蒸干并灼烧,最终得到的固体的化学式为____________。
④常温下,Ksp[Cr(OH)3]=1.0×10-32,欲使处理后废水中的c(Cr3+)降至1.0×10-5mol·L1(即沉淀完全),应调节至溶液的pH=_____。
(2)“亚硫酸盐法”吸收烟中的SO2
①将烟气通入1.0mol/L 的Na2SO3溶液,当Na2SO3恰好完全反应时,溶液pH约为3,此时,溶液中各种离子浓度由大到小的顺序为_________(用离子浓度符号和“>”号表示)。
②室温下,将烟道气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示。

已知部分弱电解质的电离常数(25℃)如下:
电解质 | 电离常数 |
H2SO3 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
NH3·H2O | Kb=1.74×10-5 |
(i)(NH4)2SO3溶液呈____(填“酸”、“碱”或“中”)性,其原因是_________________。
(ii)图中b点时溶液pH=7,则n(NH4+):n(HSO3- )=_________。
【答案】CrO42-+2H+![]() Cr2O72-+H2O 1:6 Cr2O3 5 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) 碱 H2SO3的第二电离常数Ka2=1.02×10-7小于NH3·H2O的电离常数Kb,故SO32-的水解程度比NH4+的水解程度大,溶液呈碱性 3:1
Cr2O72-+H2O 1:6 Cr2O3 5 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) 碱 H2SO3的第二电离常数Ka2=1.02×10-7小于NH3·H2O的电离常数Kb,故SO32-的水解程度比NH4+的水解程度大,溶液呈碱性 3:1
【解析】
(1) ① 从图中可以看出,c(Cr2O72) 随c(H+)的增大而不断增大,当c(H+)=6.0×10-7mol/L时,c(Cr2O72)=0.4mol/L,此时反应达平衡状态,所以此反应为可逆反应。由此可得CrO42-转化为Cr2O72-的离子方程式为CrO42-+2H+![]() Cr2O72-+H2O 答案为CrO42-+2H+
Cr2O72-+H2O 答案为CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
② 依据电子守恒,氧化剂Cr2O72与还原剂Fe2+的关系为:Cr2O72——6Fe2+
从而得出还原过程中氧化剂与还原剂的物质的量之比为1:6。答案为1:6;
③ Cr3+与Al3+的化学性质相似,说明Cr3+在水溶液中易发生水解反应,最终生成Al(OH)3,灼烧时再分解为铬的氧化物。所以对CrCl3溶液蒸干并灼烧,最终得到的固体的化学式为Cr2O3。答案为Cr2O3
④ Ksp[Cr(OH)3]=![]() 1.0×10-32
1.0×10-32
![]() ,pH=5。答案为5;
,pH=5。答案为5;
(2) ① 将烟气通入1.0mol/L 的Na2SO3溶液,当Na2SO3恰好完全反应时,全部生成NaHSO3,此时溶液pH约为3,则表明HSO3-以电离为主。
发生的电离、水解反应方程式为:HSO3-![]() H++SO32-、 HSO3-+H2O
H++SO32-、 HSO3-+H2O![]() H2SO3+OH-、H2O
H2SO3+OH-、H2O![]() H++OH- 且前面反应进行的程度大于后面反应, 从而得出溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。
H++OH- 且前面反应进行的程度大于后面反应, 从而得出溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。
答案为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
②(i)在(NH4)2SO3溶液中,NH4+、SO32-都将发生水解,从表中数据Ka2=1.02×10-7、
Kb=1.74×10-5可以看出,HSO3-的电离常数小,SO32-的水解常数大,所以溶液呈碱性。
答案为碱;
溶液呈碱性的原因是:溶液
答案为:H2SO3的第二电离常数Ka2=1.02×10-7小于NH3·H2O的电离常数Kb,故SO32-的水解程度比NH4+的水解程度大,溶液呈碱性。
(ii)图中b点时溶液pH=7,此时c(HSO3-)=c(SO32-),则c(NH4HSO3)=c[(NH4)2SO3],从而得出n(NH4+) :n(HSO3- )= 3:1 答案为3:1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法.其反应过程如图所示:

(1)反应I的化学方程式是____________________。
(2)反应I得到的产物用I2进行分离.该产物的溶液在过量I2的存在下会分成两层-含低浓度I2的H2SO4层和含高浓度I2的HI层。
①根据上述事实,下列说法正确的是__________(选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是_______________________________。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柔红酮是一种医药中间体,其结构简式如图所示。下列说法正确的是( )
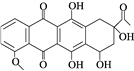
A. 每个柔红酮分子中含有2个手性碳原子
B. 柔红酮分子中所有的碳原子都在同一个平面上
C. 1 mol柔红酮最多可与2 mol Br2发生取代反应
D. 一定条件下柔红酮可发生氧化、加成、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、NO2吸收,原理如下图所示。
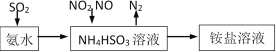
请写出NO2被吸收反应的离子方程式___________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:反应Ⅰ:2NO(g)+O2(g)==2NO2(g) ΔH1 =—113.0 kJ·molˉ1
反应Ⅱ:2SO2(g)+O2(g)==2SO3(1) ΔH2 =—288.4 kJ·molˉ1
反应Ⅲ:3NO2(g)+H2O(g)==2HNO3+NO(g) ΔH3 =—138.0 kJ·molˉ1
则反应NO2(g)+SO2(g)==NO(g)+SO3(1) ΔH4= _______________。
②已知TiO2催化尾气降解原理可表示为:2CO(g)+O2(g) ![]() 2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g)
2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g) ![]() 4HNO3(g) ΔH6。
4HNO3(g) ΔH6。
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图所示。请解释ts后NO降解率下降的可能原因_____________________。
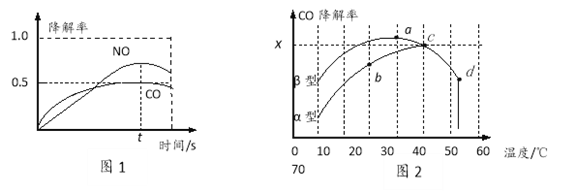
(3)沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L—1,求此温度下CO降解反应的平衡常数_______________。
②下列关于如图的叙述正确的是_________________
A.降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“![]() ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
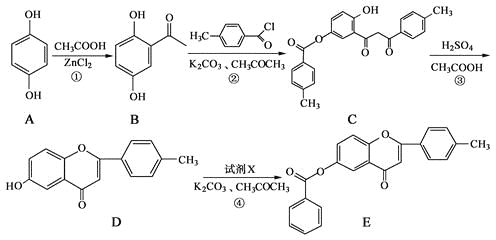
请回答下列问题:
(1)化合物B中的含氧官能团为_____和_____(填名称)。
(2)反应③中涉及到的反应类型有水解反应、_______和_______。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为_______。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有4种不同化学环境的氢。
写出该同分异构体的结构简式:___。
(5)已知: 。
。
根据已有知识并结合相关信息,写出以![]() 和CH3COOH为原料制备
和CH3COOH为原料制备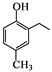 的合成路线流程图___(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图___(无机试剂任选)。合成路线流程图示例如下:
H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置及用途叙述完全正确的是
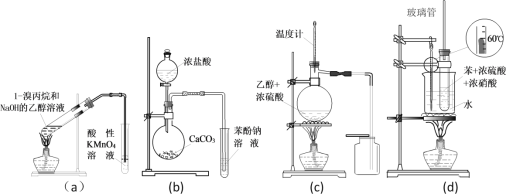
A. a装置检验消去反应后有丙烯生成
B. b装置检验酸性:盐酸>碳酸>苯酚
C. c装置用于实验室制取并收集乙烯
D. d装置用于实验室制硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在柑橘、柠檬等水果中含有柠檬酸,且已知柠檬酸中只含C、H、O三种元素。取柠檬酸19.2g,在氧气中完全燃烧,产生CO2和H2O分别为26.4g和7.2g,现对该物质进行质谱分析,可获得柠檬酸的相对分子质量为192,利用红外光谱分析可知柠檬酸分子中含有﹣COOH和﹣OH。请回答:
(1)通过计算,可获得柠檬酸的分子式为_____。
(2)再利用核磁共振氢谱分析发现有4个吸收峰,其峰面积之比为4:2:1:1.综合以上信息,写出柠檬酸的结构简式_____。
(3)柠檬酸与有机物C在一定条件下发生酯化反应可生成一种相对分子质量为220的酯类物质。写出C所有可能的结构简式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0.200molL-1盐酸滴定 20.00mL 0.200 molL-1 的 NaY 溶液,溶液中水的电离程度随所加盐酸的体积变化如图所示(忽略滴定过程中溶液体积变化),则下列有关说法正确的是[已知 Ka(HY)=5.0×10-11]

A.可选取酚酞作为滴定指示剂B.M 点溶液的 pH>7
C.Q 点水的电离程度最小,Kw<l0-14D.M点,c(Na+)=c (HY)+c (Y-)+c (Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO,其过程如下:mCeO2 (m-x)CeO2·xCe+xO2;(m-x)CeO2·xCe+xH2O+xCO2
(m-x)CeO2·xCe+xO2;(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO

下列说法不正确的是( )
A.该过程中CeO2没有消耗B.该过程实现了太阳能向化学能的转化
C.图中ΔH1=ΔH2+ΔH3D.H2(g)+O2(g)=H2O(g)的反应热大于ΔH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com