
 pC(g)+ qD(g);根据下图示回答:
pC(g)+ qD(g);根据下图示回答: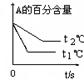
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源:不详 题型:填空题
 2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。
2C(g)+ D(s) ,5 min后达到平衡。平衡时A为1.6mol,放出的热量为Q。在t0时刻,若从平衡体系中分离出四分之一的混合气体,新平衡体系中c(A)为0.6mol/L。| 起始 n(A)/mol | 起始 n(B)/mol | 起始 n(C)/mol | 起始 n(D)/mol | 达到平衡时放出(或吸收)的热量 |
| 0 | 1.6 | 8 | 足量 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5(g) 4NO2(g)+O2(g) ΔH>0 4NO2(g)+O2(g) ΔH>0在室温下能自发进行 | 这是一个熵增的反应 |
| B | 压缩针筒内的NO2和N2O4混合气体, 颜色先变深后变浅 | 增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小 |
| C | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)十H2 (g) △H<0 , CO和H2O浓度变化如下图,
CO2(g)十H2 (g) △H<0 , CO和H2O浓度变化如下图,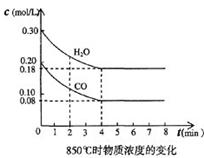
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (H2)= ;10min时,改变的外界条件可能是 .
(H2)= ;10min时,改变的外界条件可能是 .| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
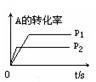
 ,测得CH4的平衡转化率与温度及压强的关系如图,下列有关说法一定正确的是
,测得CH4的平衡转化率与温度及压强的关系如图,下列有关说法一定正确的是
| A.上述反应的△H>0 |
| B.压强P1>P2>P3>P4 |
| C.1100℃该反应的平衡常数为64mol2·L-1 |
| D.压强为P4时,在Y点:v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 HCOOH + CH3OH – Q(Q>0)
HCOOH + CH3OH – Q(Q>0)| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com