
| A. | Cl2 | B. | N2 | C. | CO2 | D. | Ar |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 24克金刚石中含有的碳碳键数目为4NA | |
| B. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 1L1mol•L-1饱和FeCl3溶液滴入沸水中完全水解生成Fe(OH)3胶体粒子数为NA | |
| D. | 120克熔融的NaHSO4中含有的离子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH3与CH4互为同系物 | |
| B. | 乙醇和乙酸都能与金属钠反应 | |
| C. | 正丁烷(CH3CH2CH2CH3)与异丁烷(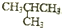 )互为同分异构体 )互为同分异构体 | |
| D. | 甲烷与苯在空气中燃烧的现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) | |
| C. | 将0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl,无沉淀析出 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl和AgNO3 | B. | Na2CO3和稀盐酸 | C. | Al2(SO4)3和NaOH | D. | 盐酸和Na[Al(OH)4] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com