
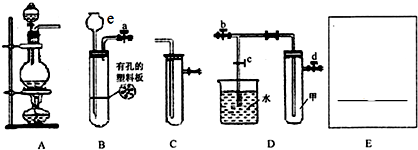
分析 (1)用浓盐酸和MnO2加热反应制取氯气是固体和液体加热制备气体,氯气有毒不能排放到空气中需要通过氢氧化钠溶液吸收;
(2)用稀盐酸和大理石常温下反应制备CO2时是固体和液体不加热反应制备气体,装置图中e仪器的名称为长颈漏斗,碳酸钙和盐酸反应生成氯化钙、二氧化碳和水;
(3)根据二氧化氮能和水反应,则烧杯内气体的压强会减小进行分析解答;
解答 解:(1)用浓盐酸和MnO2加热反应制取氯气是固体和液体加热制备气体,所以选择装置A和C,氯气有毒不能排放到空气中需要通过装置E中氢氧化钠溶液吸收,装置图为: ,
,
故答案为:A, ;
;
(2)用稀盐酸和大理石常温下反应制备CO2时是固体和液体不加热反应制备气体,装置图中e仪器的名称为长颈漏斗,碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,反应的离子方程式为:CaCO3+2H+═Ca2++H2O+CO2↑,
故答案为:长颈漏斗,CaCO3+2H+═Ca2++H2O+CO2↑;
(3)二氧化氮能和水反应,则烧杯内气体的压强会减小,小于外界大气压,烧杯中的溶液会倒流于试管中,所以先关闭止水夹 ab,再打开止水夹 c,使烧杯中的水进入试管,二氧化氮和水反应生成硝酸显酸性,然后用双手捧捂D中的试管(或用酒精灯加热),烧杯中的导管口有气泡,同时,观察到滴有石蕊的水面沿导管上升并呈红色
故答案为:用双手捧捂D中的试管(或用酒精灯加热),烧杯中的导管口有气泡,同时,观察到滴有石蕊的水面沿导管上升并呈红色;
点评 本题考查了气体制备的装置选择、气体除杂、气密性检查等实验基本操作,气体性质和气体制备的方法是解题关键,注意装置图的理解应用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,l.6gCH4中含有共价键总数为0.4NA | |
| B. | 常温常压下,2.24 L NO2气体中含有NO2分子数为0.1NA | |
| C. | 1 L0.lmol•L-1的醋酸中含有H十离子数为0.1NA | |
| D. | 铝热反应中1 molFe3O4完全反应,转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 16 | C. | 24 | D. | 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
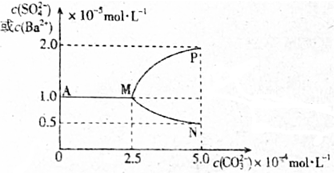
| A. | T℃时Ksp(BaSO4)<Ksp(BaCO3) | |
| B. | 当c(CO32-)大于2.5×10-4mol•L-1时开始有BaCO3沉淀生成 | |
| C. | 图象中代表沉淀转化过程中c(Ba2+)随c(CO32-)变化的曲线是MP | |
| D. | 反应BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq)的平衡常数K=0.04 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 硝酸银溶液与铁粉反应:2Ag++Fe═Fe2++2Ag | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
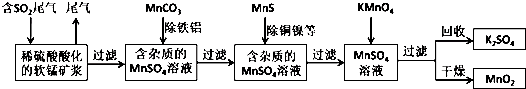
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com