
【题目】(14分)发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g)![]() CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H________(填“增大”、“减小”或“不变”),判断的理由是________。
CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H________(填“增大”、“减小”或“不变”),判断的理由是________。
(2)CO2制备甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH=-49.0kJ·mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如右图所示。
CH3OH(g)+H2O(g)ΔH=-49.0kJ·mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如右图所示。
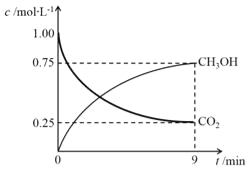
①该反应化学平衡常数K的表达式是________。
②0~9min时间内,该反应的平均反应速率ν(H2)=________。
③在相同条件下,密闭容器的体积缩小至0.5L时,此反应达平衡时放出的热量(Q)可能是________(填字母序号)kJ。
a.0<Q<29.5
B.29.5<Q<36.75
C.36.75<Q<49
D.49<Q<98
④在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如右图所示,L和X分别表示温度或压强。
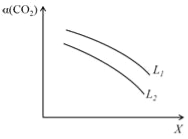
X表示的物理量是。判断L1与L2的大小关系。
(3)科学家用氮化镓材料与铜组装如右图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.
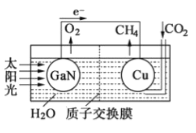
写出铜电极表面的电极反应式,为提高该人工光合系统的工作效率,可向装置中加入少量(选填“盐酸”或“硫酸”).
(4)利用CO2和NH3为原料也合成尿素,在合成塔中的主要反应可表示如下:
反应①:2NH3(g)+CO2(g)=NH2CO2NH4(s)△H1=__________________
反应②:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H2=+72.49kJ·mol-1
总反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-86.98kJ·mol-1;
则反应①的△H1=_______________。
(5)现将amol铁和bmol铜的混合物与含有cmolHNO3的稀溶液充分反应,设还原产物为NO。下列结论不正确的是(填序号)
A.若剩余金属0.5amol,则氧化产物为一种或二种
B.若只有一种氧化产物,则3c=8a
C.若有二种氧化产物,被还原的硝酸物质的量为0.25cmol
D.若有三种氧化产物,被还原的硝酸物质的量为0.25cmol
【答案】(1)不变(2)①0.25mol·L-1·min-1②c③温度L1>L2
(3)CO2+8H++8e-=CH4+2H2O硫酸;
(4)-159.47kJ/mol(5)BC
【解析】
试题分析:(1)将煤转化成水煤气的反应:C(s)+H2O![]() CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),催化剂改变反应速率不改变化学平衡,不改变反应焓变,此反应的△H不变;
CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),催化剂改变反应速率不改变化学平衡,不改变反应焓变,此反应的△H不变;
(2)①依据图像读取甲醇生成浓度,结合反应速率概念计算甲醇的反应速率=0.75mol/L÷9min,反应速率之比等于化学方程式计量数之比,V(H2)=3V(CH3OH(g)=3×0.75mol/L/9min=0.25mol/(Lmin);
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJmol-1,反应达到平衡状态消耗二氧化碳物质的量浓度=1mol/L-0.25mol/L=0.75mol/L,物质的量为0.75mol,反应放出热量=49kJ/mol×0.75mol=36.75kJ,反应焓变是指1mol二氧化碳和3mol氢气完全反应放出的热量为49kJ,反应是可逆反应,在体积为1L的密闭容器中,充入1molCO2和3molH2,反应放热一定小于49kJ,在相同条件下,密闭容器的体积缩小至0.5L时,压强增大,平衡正向进行,反应放出热量会增多,大于36.75kJ,则36.75<Q<49,答案选c;③CO2(g)+3H2(g)
CH3OH(g)+H2O(g)△H=-49.0kJmol-1,反应达到平衡状态消耗二氧化碳物质的量浓度=1mol/L-0.25mol/L=0.75mol/L,物质的量为0.75mol,反应放出热量=49kJ/mol×0.75mol=36.75kJ,反应焓变是指1mol二氧化碳和3mol氢气完全反应放出的热量为49kJ,反应是可逆反应,在体积为1L的密闭容器中,充入1molCO2和3molH2,反应放热一定小于49kJ,在相同条件下,密闭容器的体积缩小至0.5L时,压强增大,平衡正向进行,反应放出热量会增多,大于36.75kJ,则36.75<Q<49,答案选c;③CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJmol-1,反应是气体体积减小的放热反应,i.温度升高,平衡逆向进行,二氧化碳转化率减小,所以X为温度,L为压强;ii.温度一定压强增大平衡正向进行二氧化碳转化率增大,所以L1>L2;
CH3OH(g)+H2O(g)△H=-49.0kJmol-1,反应是气体体积减小的放热反应,i.温度升高,平衡逆向进行,二氧化碳转化率减小,所以X为温度,L为压强;ii.温度一定压强增大平衡正向进行二氧化碳转化率增大,所以L1>L2;
(3)根据电子的流向可知铜电极是正极,CO2得到电子转化为甲烷,则正极反应式为CO2+8H++8e-=CH4+2H2O;由于盐酸易挥发,生成的甲烷中会混有HCl气体,所以选用硫酸,不用盐酸;
(4)已知:反应②:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H2=+72.49kJ·mol-1
③:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-86.98kJ·mol-1
则根据盖斯定律可知③-②即得到反应①:2NH3(g)+CO2(g)=NH2CO2NH4(s)的△H1=-159.47kJ/mol;
(5)A、若剩余金属0.5amol,该金属可能为铁或铜,若为铁,则溶质为硝酸亚铁,若为铜,则氧化产物可能为硝酸亚铁和硝酸铜,A正确;B、若只有一种氧化产物,说明铁过量,铜没有参与反应,反应后溶质为硝酸亚铁,但是amol铁不一定完全反应,无法确定a与c的关系,B错误;C、若只有二种氧化产物,氧化产物可能为硝酸亚铁和硝酸铜或硝酸铜和硝酸铁,硝酸可能过量,稀硝酸不一定完全反应,则无法计算被还原的硝酸的量,C错误;D、若有三种氧化产物,氧化产物为硝酸铜、硝酸铁和硝酸亚铁,说明硝酸完全反应,根据反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O、Fe+4HNO3=Fe(NO3)3+NO↑+2H2O可知,被还原的硝酸的物质的量为cmol×1/4=0.25cmol,D正确;答案选BC。


科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中![]() 减小
减小
B.在0.1mol·L-1的稀硫酸加水稀释的过程中,c(H+):c(SO42-)始终为2:1
C.向盐酸中加入氨水至中性,溶液中
D.在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.化学反应都伴随着热量的变化
B.个别化学反应与能量变化无关
C.某些吸热反应在不加热条件下也能发生
D.放热反应的发生无需任何条件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果 .(填“偏大”、“偏小”、或“不变”)
(2)从石油中分离出汽油、煤油和柴油等,所采用的方法是 .(填“干馏”或“分馏”)
(3)除去二氧化碳气体中的氯化氢杂质,选用的试剂是 .(填“NaOH溶液”或“饱和NaHCO3溶液”)
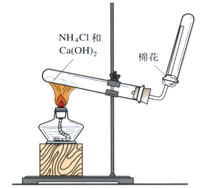
(4)如图是实验室制取氨气的装置,回答下列问题:
①收集氨气的方法是 排空气法.
②验证氨气是否收集满的方法是 .(写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、材料等密切相关,下列说法错误的是
A. 陶瓷是硅酸盐产品
B. 葡萄糖可用于制镜业
C. 纸的主要成分为纤维素
D. 汉白玉的主要成分碳酸钙属于碱类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 植物油中由于含有碳碳双键,因此在空气中长时间放置容易氧化变质
B. 利用乙醇的氧化性以及Cr3+、Cr2O72-的颜色差异来检验酒后驾车
C. 石油可以通过裂解、裂化等物理变化获得重要化工原料乙烯
D. 黄河入海口沙洲的形成体现了胶体电泳的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.5 g锌投入100 mL 2 mol/L的稀硫酸(已知溶液密度为1.12 g/cm3)中充分反应。试计算
(1)产生的氢气在标准状况下的体积。
(2)反应后所得溶液的质量。
(3)现有2 mol/L的稀盐酸和稀硫酸各100 mL,分别加入等质量的铁,反应后生成的气体在标准状况下的体积比为2∶3,求加入铁的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器在测定稀盐酸和氢氧化钠稀溶液中和反应反应热的实验中没有使用到的是( )
①大、小烧杯 ②容量瓶 ③量筒 ④环形玻璃搅拌棒
⑤试管 ⑥温度计 ⑦蒸发皿 ⑧托盘天平
A. ①②⑥⑦ B. ②⑤⑦⑧
C. ②③⑦⑧ D. ③④⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com