
| A. | 等体积、等物质的量浓度的氨水与盐酸混合 | |
| B. | 常温下,pH=8的氨水与pH=6的硝酸等体积混合 | |
| C. | 常温下,pH=12的Ba(OH)2溶液与pH=2的NaHSO4溶液等体积混合 | |
| D. | c(H+)=c(OH-)=10-6 mol•L-1的溶液 |
分析 溶液呈酸碱性本质,取决与溶液中H+浓度与OH-浓度的相对大小,当溶液中:c(H+)>c(OH-),溶液呈酸性;c(H+)=c(OH-),溶液呈中性;c(H+)<c(OH-),溶液呈碱性;常温下,水的离子积Kw=1×10-14,所以,pH<7,溶液呈酸性;pH=7,溶液呈中性;pH>7,溶液呈碱性.Kw受温度影响,水的电离是吸热反应,温度越高Kw越大,据此进行判断.
解答 解:A、等体积、等物质的量浓度的氨水与盐酸混合,完全反应生成氯化铵,水解呈酸性,故A错误;
B、常温下,pH=8的氨水与pH=6的硝酸等体积混合,生成硝酸铵和氨水的混合溶液,氨水的电离为主,溶液呈碱性,故B错误;
C、常温下,pH=12的Ba(OH)2溶液与pH=2的NaHSO4溶液等体积混合,氢离子与氢氧根离子恰好完全反应,溶液呈中性,故C正确;
D、c(H+)=c(OH-)溶液呈中性,故D正确;
故选CD.
点评 本题考查了溶液酸碱性的判断,溶液的酸碱性是由溶液中H+浓度与OH-浓度的相对大小决定的,而不在于c(H+)或c(OH-)绝对值的大小,题目难度不大.


科目:高中化学 来源: 题型:解答题
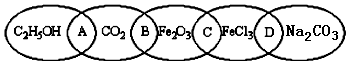
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
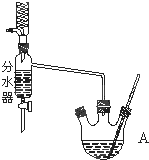 如图为制取乙酸乙酯的实验装置图.回答下列问题:
如图为制取乙酸乙酯的实验装置图.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
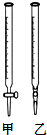 NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).
NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).| 滴定次数 | 待测溶液A的体积(/mL) | 0.1000mol•L-1NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱式滴定管只用水洗,而未用待测液润洗 | |
| B. | 锥形瓶中残留有蒸馏水 | |
| C. | 酸式滴定管滴定前尖嘴处有气泡,滴定后气泡消失 | |
| D. | 滴定前仰视刻度读数,滴定后俯视刻度读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用标准FeCl3溶液滴定KI溶液,选择KSCN溶液 | |
| B. | 用I2溶液滴定Na2SO3溶液,淀粉作指示剂 | |
| C. | 用AgNO3溶液滴定NaCl溶液,Na2CrO4作指示剂 | |
| D. | 用H2O2溶液滴定KI溶液,淀粉作指示剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com