
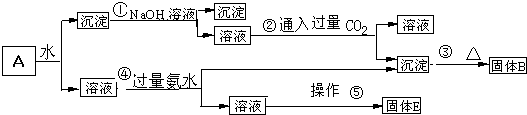
分析 KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3,故B为Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4 和(NH4)2SO4,以此解答该题.
解答 解:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中通入CO2可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3,故B为Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4 和(NH4)2SO4,经过蒸发、结晶,得到的是K2SO4 和(NH4)2SO4,
(1)由上述分析可知B为Al2O3,溶液E为K2SO4、(NH4)2SO4,
故答案为:Al2O3;K2SO4、(NH4)2SO4;
(2)反应①为Al2O3与NaOH溶液反应生成NaAlO2,反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,沉淀加入氢氧化钠后,溶液的主要成分为偏铝酸钠,通入二氧化碳,反应生成氢氧化铝,化学方程式为NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3;
(3)KAl(SO4)2与过量氨水反应生成氢氧化铝沉淀,方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
(4)操作⑤为结晶操作,由溶液得到固体,可进行蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶;
(5)铝为重要金属材料,可用于建筑材料外墙、门窗、汽车车轮骨架、飞机构件、电子元件等,
故答案为:建筑材料外墙、门窗、汽车车轮骨架、飞机构件、电子元件.
点评 本题考查无机物的推断,为高频考点,综合考查元素化合物性质,侧重Al、Fe及其化合物性质的考查,注意氧化铝的两性,明确发生的化学反应为解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 反应:SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,说明H2SiO3的酸性大于H2CO3的酸性 | |
| B. | 因为SO2具有漂白性,所以它能使品红溶液、溴水褪色 | |
| C. | 二氧化硅是生产光导纤维、玻璃的基本原料 | |
| D. | CO2、CH4、N2是温室气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:
已知A、B、C、D四种元素均为短周期元素,原子序数依次递增,E为前30号元素.5种元素的部分特点:| 元素 | 特 点 |
| A | 其气态氢化物呈三角锥形,水溶液显碱性 |
| B | 基态原子核外有三个能级,其中最外层电子数等于次外层电子数的3倍 |
| C | 基态原子占据两种形状的原子轨道,且最外层电子数等于最内层电子数 |
| D | 元素原子的外围电子层排布式为nsn-1npn-1 |
| E | 原子M能级层为全充满状态且核外的未成对电子只有一个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.
;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 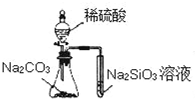 实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 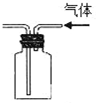 实验装置排空气法收集CO2气体 | |
| C. | 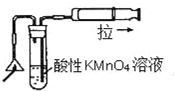 可以检验火柴燃烧生成的SO2气体 | |
| D. |  提取海带中的碘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com